Сульфорафан це фітохімічна речовина, речовина в групі ізотіоціанатних сіркоорганічних сполук, що міститься в хрестоцвітних овочах, таких як брокколі, капуста, цвітна та брюссельська капуста. Його також можна знайти в бок-чої, капусті, капусті, зелені гірчиці та крес-салата. Дослідження показали, що сульфорафан може допомогти запобігти різним типам раку активація виробництва Nrf2, або ядерний фактор, пов’язаний з еритроїдом 2, фактор транскрипції, який регулює захисні антиоксидантні механізми, які контролюють реакцію клітини на окислювачі. Мета наступної статті — описати функцію сульфорафану.
зміст
абстрактний
Антиоксидантна система KEAP1-Nrf2-ARE є основним засобом, за допомогою якого клітини реагують на окислювальний і ксенобіотичний стрес. Сульфорафан (SFN), електрофільний ізотіоціанат, отриманий з овочів хрестоцвітих, активує шлях KEAP1-Nrf2-ARE і став молекулою, що представляє інтерес у лікуванні захворювань, у яких головну етіологічну роль відіграє хронічний окислювальний стрес. Тут ми демонструємо, що мітохондрії культивованих клітин пігментного епітелію сітківки сітківки (RPE-1) людини, оброблених SFN, піддаються гіперфузії, яка не залежить як від Nrf2, так і від його цитоплазматичного інгібітора KEAP1. Повідомляється, що злиття мітохондрій є цитопротекторним шляхом інгібування утворення пор в мітохондріях під час апоптозу, і відповідно до цього ми показуємо Nrf2-незалежний цитозахист клітин, оброблених SFN, підданих впливу індуктора апоптозу, стауроспорину. Механічно SFN пом’якшує залучення та/або утримання розчинного фактора поділу Drp1 в мітохондріях і пероксисомах, але не впливає на загальну кількість Drp1. Ці дані демонструють, що корисні властивості SFN виходять за межі активації системи KEAP1-Nrf2-ARE і вимагають подальшого допиту, враховуючи поточне використання цього агента в численних клінічних дослідженнях.
Ключові слова: Сульфорафан, Nrf2, Drp1, мітохондрії, поділ, злиття, апоптоз
Вступ
Сульфорафан - це Nrf2-незалежний інгібітор мітохондріального поділу
Сульфорафан (SFN) — ізотіоціанатна сполука, що одержується в раціоні, найчастіше з овочів хрестоцвітих [56]. Він утворюється в рослинах як ксенобіотична відповідь на хижацтво через везикулярне вивільнення гідролітичного ферменту мірозинази з пошкоджених клітин; цей фермент перетворює глюкозинолати в ізотіоціанти [42]. Протягом останніх двох десятиліть SFN широко охарактеризований через його протиракові, антиоксидантні та антимікробні властивості [57]. Значна частина цієї ефективності пояснюється здатністю SFN модулювати сигнальний шлях KEAP1-Nrf2-антиоксидантної відповіді (ARE), хоча були виявлені додаткові дії сполуки, включаючи інгібування активності гістондеацетилази та прогресування клітинного циклу [ 29]. Nrf2 є головним антиоксидантним фактором транскрипції і в умовах гомеостазу його стабільність пригнічується під дією цитоплазматичного комплексу убіквітинлігази Cullin3KEAP1 [20]. Зокрема, Nrf2 залучається до лігази Cullin3KEAP1 шляхом зв’язування з димерним субстратним адаптером KEAP1 і згодом модифікується ланцюгами polyUb, які спрямовані на фактор транскрипції для опосередкованої протеасомою деградації. Цей конститутивний оборот обмежує період напіввиведення Nrf2 в клітинах без стресу до ~15 хв [30], [33], [46], [55]. У відповідь на численні типи стресу, зокрема окислювальний стрес, KEAP1, багатий цистеїном білок, діє як окислювально-відновний датчик, а окислювальна модифікація критичних цистеїнів, зокрема C151, KEAP1 відокремлює Nrf2-KEAP1 від CUL3, таким чином запобігаючи деградації Nrf2 [ 8], [20], [55]. Примітно, що SFN і, можливо, інші активатори Nrf2 імітують окислювальний стрес шляхом модифікації C151 KEAP1, наприклад [21]. Стабілізація Nrf2 забезпечує його транслокацію в ядро, де він індукує експресію батареї антиоксидантних і детоксикаційних генів фази II. Nrf2 зв’язується з елементами промотору антиоксидантної відповіді (ARE) своїх споріднених цільових генів шляхом гетеродимеризації невеликими білками Maf [19]. Ця система представляє динамічну та чутливу реакцію на непрямі антиоксиданти, такі як SFN, вільні радикали, що утворюються мітохондріями [16], або інші фізіологічні джерела окисного стресу [41].
Мітохондрії – це динамічні субклітинні органели, які регулюють безліч клітинних функцій, починаючи від виробництва АТФ і внутрішньоклітинної буферизації кальцію до окислювально-відновної регуляції та апоптозу [13], [49]. Мітохондрії також є основним джерелом активних форм кисню (АФК) всередині клітини. Тому правильна регуляція мітохондріальної функції необхідна для оптимізації виробництва АТФ для задоволення потреб клітин, одночасно зводячи до мінімуму потенційно шкідливі ефекти надмірного виробництва вільних радикалів. Критичною вимогою для тонкої модуляції мітохондріальної функції є здатність мітохондрій функціонувати як незалежно як біохімічні машини, так і як частина величезної мережі, що реагує.
Морфологія і функція мітохондріальної мережі визначаються регульованим балансом між поділом і злиттям. Ділення мітохондрій необхідне для успадкування мітохондрій дочірньою клітиною під час поділу клітини [28], а також для селективної аутофагічної деградації деполяризованих або пошкоджених мітохондрій, що називається мітофагією [1]. І навпаки, злиття необхідне для комплементації мітохондріальних геномів і спільного використання компонентів ланцюга транспорту електронів між сусідніми мітохондріями [54]. На молекулярному рівні поділ і злиття мітохондрій регулюються великими динаміноподібними ГТФазами. Три ферменти головним чином регулюють злиття: мітофузини 1 і 2 (Mfn1/2) є двопрохідними зовнішніми мембранними білками, які опосередковують злиття зовнішньої мембрани за допомогою гетеротипних взаємодій між сусідніми мітохондріями [15], [25], [37], тоді як OPA1 є внутрішнім мембранний білок, який одночасно забезпечує зв’язність матриці, регулюючи злиття внутрішніх мембран [5]. Активність ГТФази всіх трьох білків необхідна для надійного злиття [5], [18], а OPA1 додатково регулюється комплексним протеолізом у внутрішній мембрані мітохондрій протеазами OMA1 [14], PARL [6] і YME1L [45]. ]. Важливо, що потенціал інтактної мітохондріальної мембрани необхідний для ефективного злиття, щоб придушити інтеграцію пошкоджених і здорових мітохондрій [26].
Ділення мітохондрій в основному каталізується цитозольним білком, який називається білком 1, пов’язаним з Dynamin (Drp1/DNM1L). Drp1 рекрутується з цитозолю до передбачуваних місць поділу на зовнішній мембрані мітохондрій [43]. Основними рецепторами для Drp1 на зовнішній мембрані є мітохондріальний фактор поділу (Mff) [32] і, меншою мірою, Fission 1 (Fis1) [51]. Крім того, було виявлено рецептор-приманку, MIEF1/MiD51, який діє для подальшого обмеження активності білка Drp1 у потенційних місцях поділу [58]. Після прикріплення до зовнішньої мембрани мітохондрії Drp1 олігомеризується в спіралеподібні структури навколо тіла мітохондрії, а потім використовує енергію, отриману від гідролізу GTP, для опосередкування фізичного розщеплення зовнішньої та внутрішньої мембран мітохондрій [17]. Трубочки, отримані з ендоплазматичної мережі, діють як початковий констриктор мітохондрій до олігомеризації Drp1, підкреслюючи відкриття, що незвужені мітохондрії ширші, ніж дозволена окружність завершеної спіралі Drp1 [12]. Динаміка актину також важлива для взаємодії ЕР-мітохондрій, які передують поділу мітохондрій [24]. На додаток до своєї ролі в поділі мітохондрій, Drp1 каталізує поділ пероксисом [40].
Drp1 дуже схожий на добре охарактеризований білок динамін тим, що обидва білки містять N-кінцевий домен GTPase, середній домен, який є критичним для самоолігомеризації, і C-кінцевий ефекторний домен GTPase [31]. Drp1 досягає селективності для мітохондріальних мембран завдяки комбінації взаємодій з його рецепторними білками Mff і Fis1, а також завдяки спорідненості до мітохондрій-специфічного фосфоліпідного кардіоліпіну через унікальний В-вставний домен Drp1 [2]. Drp1 зазвичай існує як гомотетрамер у цитоплазмі, а збірка вищого порядку в місцях поділу мітохондрій опосередковується середнім доменом Drp1 [3].
Враховуючи неявний зв’язок між мітохондріальною функцією та шляхом KEAP1-Nrf2-ARE, ми досліджували вплив активації Nrf2 на структуру та функцію мітохондрій. Тут ми демонструємо, що SFN індукує гіперфузію мітохондрій, яка несподівано не залежить як від Nrf2, так і від KEAP1. Цей ефект SFN відбувається через пригнічення функції Drp1. Далі ми демонструємо, що SFN надає стійкість до апоптозу, яка не залежить від Nrf2 і імітує те, що спостерігається в клітинах, збіднених Drp1. Ці дані разом вказують на те, що на додаток до стабілізації та активації Nrf2, SFN модулює мітохондріальну динаміку та зберігає придатність і виживання клітин.
результати
Сульфорафан викликає Nrf2/KEAP1-незалежну гіперфузію мітохондрій
У ході вивчення впливу активації Nrf2 на динаміку мітохондріальної мережі ми виявили, що обробка імморталізованих клітин пігментного епітелію сітківки людини (RPE-1) сульфорафаном (SFN), потужним активатором передачі сигналів Nrf2, індукує міцне злиття мітохондріальну мережу в порівнянні з контрольними клітинами, обробленими транспортним засобом (рис. 1A і B). Морфологія мітохондрій у цих клітинах дуже нагадувала морфологію мітохондрій у клітинах, збіднених siRNA ендогенного Drp1, основного фактора мітохондріального поділу (рис. 1A). Цей результат викликав інтригуючу ідею, що стан поділу та злиття мітохондрій безпосередньо реагує на рівні Nrf2 в клітині. Однак стимуляція клітин іншими стабілізаторами та активаторами Nrf2, такими як інгібітор протеасоми MG132, прооксидант tBHQ, або нокдаун інгібітора Nrf2 KEAP1 не викликали злиття мітохондрій (рис. 1A і B). Стабілізація Nrf2 за допомогою цих маніпуляцій була підтверджена вестерн-блоттингом для ендогенного Nrf2 (рис. 1C). Крім того, експресія Nrf2 була необхідна для SFN-індукованого мітохондріального злиття, оскільки нокдаун ендогенного Nrf2 за допомогою siRNA не зміг протистояти цьому фенотипу (рис. 1D�F). Оскільки SFN стимулює шлях KEAP1-Nrf2-ARE шляхом ковалентної модифікації залишків цистеїну KEAP1 [21], ми знищили KEAP1, щоб вирішити, чи стимулюється SFN-індукована гіперфузія мітохондрій через KEAP1-залежний, але незалежний шлях від Nrf2. Однак виснаження KEAP1 також не вдалося скасувати індукований SFN мітохондріальний злиття (рис. 1G�I). Фактично, SFN змінив морфологію професійного поділу, викликану виснаженням KEAP1 (рис. 1G, панель b проти панелі d). Ці результати вказують на те, що лікування SFN викликає злиття мітохондрій незалежно від канонічного шляху KEAP1-Nrf2-ARE, і підштовхнуло нас до питання, чи впливає SFN безпосередньо на компоненти мітохондріального поділу або механізму злиття.
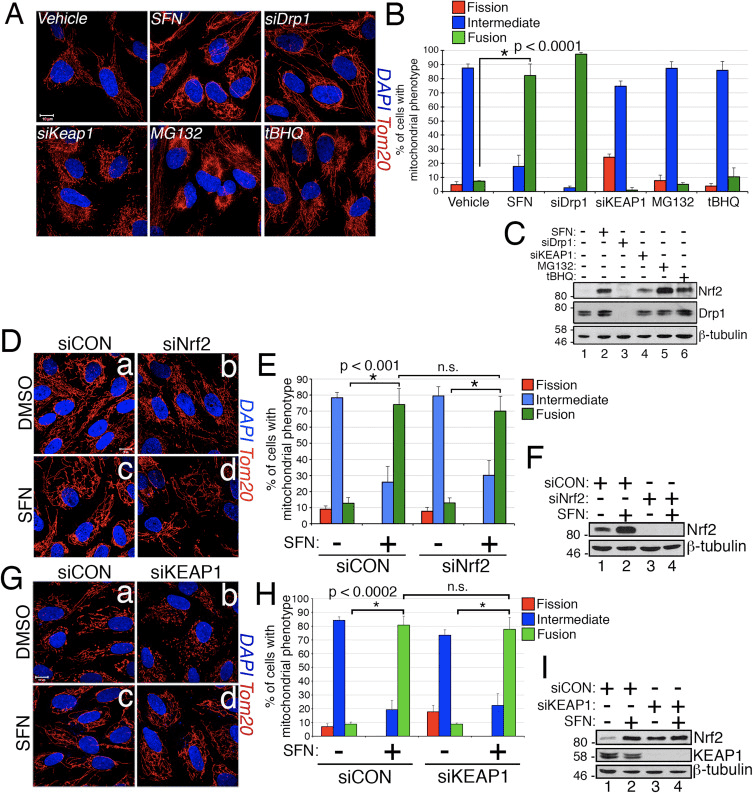
Сульфорафан порушує мітохондріальну асоціацію Drp1
Виходячи з висновку, що лікування SFN викликає гіперфузію мітохондрій, ми прийшли до висновку, що цей фенотип був або наслідком надмірної активності злиття, або пригніченням активності поділу. Щоб розрізнити ці дві можливості, ми порівняли морфологію пероксисом у присутності та відсутності SFN. Пероксисоми подібні до мітохондрій тим, що вони є динамічними органелами, форма і довжина яких постійно змінюються [44]. Пероксисоми містять як Fis1, так і Mff у своїй зовнішній мембрані і, як наслідок, є мішенями для Drp1-опосередкованого поділу [22], [23]. Однак пероксисоми не використовують механізм злиття мітохондріальної мережі і, отже, не зазнають злиття [39]. Швидше, пероксисомальному поділу протистоїть подовження існуючих пероксисом за рахунок de novo додавання мембран і білків [44]. Оскільки в пероксисомах відсутні Mfn1/2 та OPA1, ми прийшли до висновку, що якщо SFN активує механізм злиття, а не інгібує механізм поділу, довжина пероксисом не вплине. У клітинах, оброблених носієм, пероксисоми зберігаються у вигляді коротких круглих точковидних органел (рис. 2, панелі b і d). Однак лікування SFN збільшило довжину пероксисом приблизно в 2 рази порівняно з контрольними клітинами (рис. 2, панелі f і h). Крім того, багато пероксисом були защемлені поблизу центру, що вказує на потенційний дефект розрізу (рис. 2, панель h, наконечники стрілок). Аналогічно, пероксисоми в клітинах, трансфікованих миРНК Drp1, були аномально довгими (рис. 2, панелі j і l), що підтверджує, що Drp1 необхідний для пероксисомального поділу, і припускає, що лікування SFN викликає мітохондріальні та пероксисомні фенотипи, порушуючи механізм поділу.
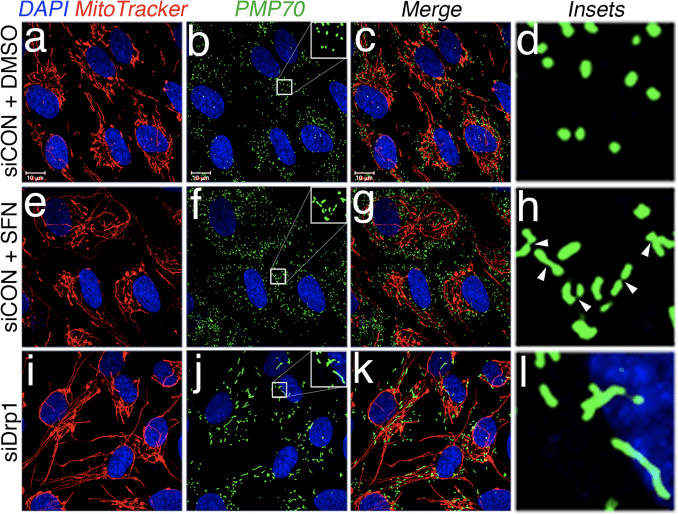
Далі ми визначили, як SFN обмежує функцію Drp1. Можливості включали зниження рівня експресії, рекрутування/утримання в мітохондріях, олігомеризацію або ферментативну активність GTPase. Дефіцит будь-якого з них призведе до зниження мітохондріального поділу та гіперфузії. Ми не виявили відтворюваних змін у рівнях білка Drp1 після лікування SFN (рис. 1C і 3A), і тому дійшли висновку, що SFN не змінює стабільність або експресію Drp1, відповідно до того, що Drp1 має період напіввиведення >10 годин [50] і наші лікування SFN мають меншу тривалість. Далі ми дослідили, чи впливає SFN на залучення або утримання Drp1 в мітохондріях. Дослідження фракціонування показали, що SFN викликав втрату Drp1 з мітохондріальної фракції (рис. 3A, доріжки 7�8 і рис. 3B). Як повідомлялося раніше [43], лише незначна частина Drp1 (~3%) пов’язана з мітохондріальною мережею в будь-який момент часу під час стаціонарних умов, при цьому більшість ферменту знаходиться в цитоплазмі (рис. 3A, доріжки 5�8 ). Ці дані фракціонування були підтверджені за допомогою аналізу спільної локалізації, який показав зменшення на 40% у мітохондріях точкових вогнищ Drp1 після обробки SFN (рис. 3C і D). Разом ці дані вказують на те, що злиття мітохондрій, викликане SFN, принаймні частково зумовлене ослабленою асоціацією Drp1 з мітохондріями. Наші дані не розрізняють, чи впливає SFN на рекрутацію мітохондрій від утримання Drp1 у мітохондріях, чи обидва, оскільки аналіз ендогенного Drp1 не піддавався візуалізації GTPази за допомогою мікроскопії живих клітин.
Сульфорафан забезпечує захист від апоптозу, індукованого стауроспортином, незалежно від Nrf2
Попередня робота показала, що поділ мітохондрій є дозволеним у формуванні пір у зовнішній мітохондріальній мембрані, утворених Bax/Bak під час апоптозу [11]. Показано, що Drp1 вибірково залучається до мітохондрій під час апоптозу [11], і, відповідно до цього, фрагментовані мітохондрії спостерігалися на початку процесу [27]. І навпаки, вважають, що інгібування поділу мітохондрій пригнічує апоптоз, блокуючи утворення пор зовнішньої мембрани, які забезпечують вивільнення цитохрому c [53]. Відповідно, стимуляція злиття мітохондрій затримує прогресування апоптозу, індукованого сполуками, включаючи стауроспорин (STS) [14]. Щоб визначити, чи захищає SFN клітини RPE-1 від апоптозу, опосередкованого STS, і якщо так, то чи потрібен для цього Nrf2, ми створили аналіз, щоб легко індукувати розщеплення поліАДФ рибозополімерази (PARP), субстрату активованої каспази-3 і остаточного маркера апоптоз. Обробка клітин RPE-1 1 мкМ STS протягом 6 годин викликала лише дуже помірне розщеплення PARP, але цьому було попереджено спільне лікування SFN (наприклад, рис. 4A, доріжка 3 проти 4). Щоб підвищити надійність цього аналізу, ми додатково сенсибілізували клітини до апоптозу, індукованого STS, попередньо обробивши їх siRNA, спрямованою на антиапоптотичний фактор, Bcl-XL. Ця попередня обробка зменшувала експресію Bcl-XL і помітно сприяла розщепленню PARP як функції часу впливу STS (рис. 4B, порівняйте доріжку 2 з доріжками 4÷10). Важливо, що 2 години попередньої обробки SFN пом’якшили розщеплення PARP в клітинах, підданих STS (рис. 4C, доріжка 3 проти 4 і доріжка 5 проти 6). Аналогічно, клітини, стабільно виснажені Nrf2 за допомогою CRISPR/Cas9, були порівняно захищені від токсичності STS попередньою обробкою SFN (рис. 4C, доріжка 11 проти 12 і смуга 13 проти 14 і рис. 4D). Цей захист спостерігали, використовуючи як розщеплення PARP (рис. 4C і D), так і клітинну морфологію (рис. 4E) як показання. Ефективність виснаження Nrf2 за допомогою CRISPR/Cas9 була підтверджена вестерн-блоттингом (рис. 4C, Nrf2 блот). Як було передбачено, виснаження клітин Drp1, яке також дає фенотип гіперфузії (рис. 1A), також блокує розщеплення PARP у відповідь на STS порівняно з контрольними клітинами, інкубованими з SFN (рис. 4F та G). Разом ці висновки узгоджуються з тим, що SFN забезпечує захист від апоптозу через його здатність обмежувати функцію Drp1, незалежно від стабілізації та активації Nrf2.
Обговорення
Ми виявили, що SFN модулює динаміку мітохондріального поділу/злиття незалежно від його впливу на шлях KEAP1-Nrf2-ARE. Це інтригує через передбачуваний зв’язок між мітохондріальною дисфункцією та продукцією АФК та необхідністю придушення вільних радикалів, отриманих з мітохондрій, шляхом активації Nrf2. Цей додатковий функціональний вплив SFN має потенційне значення з огляду на більш ніж 30 клінічних випробувань, які в даний час проводяться з тестування SFN для лікування різноманітних захворювань, включаючи рак передміхурової залози, обструктивну хворобу легенів та серповидно-клітинну хворобу [7], [10], [ 47].
Оскільки SFN є ізотіоціанатом [56] і він активує передачу сигналів Nrf2 шляхом безпосереднього ацилювання критичних цистеїнів KEAP1 для придушення деградації Nrf2 [21], випливає, що SFN виявляє свої ефекти про-злиття, модулюючи активність фактора поділу або злиття за допомогою модифікації цистеїну. . Наші дані впевнено підтверджують, що Drp1 негативно регулюється SFN, хоча залишається з’ясувати, чи є GTPase прямою мішенню ацилювання. Незважаючи на цей пробіл у знаннях, функція Drp1 явно порушується SFN, оскільки і мітохондрії, і пероксисоми стають гіперфузією у відповідь на лікування SFN, і ці органели спільно використовують Drp1 для відповідних подій розщеплення [38]. Крім того, SFN зменшує кількість Drp1, який локалізується та накопичується в мітохондріях (рис. 3). Оскільки наші експерименти проводилися з усіма ендогенними білками, наше виявлення Drp1 в місцях поділу мітохондрій відбувається в стаціонарних умовах, і, отже, ми не можемо відрізнити рекрутинг від дефекту утримання ферменту, викликаного SFN. Крім того, ми не можемо виключити можливість того, що SFN ацилює рецептор у мітохондріях (Fis1 або Mff), щоб блокувати рекрутинг Drp1, ми підозрюємо, що Drp1 безпосередньо модифікований. Drp1 містить дев'ять цистеїнів, вісім з яких знаходяться в середньому домені, необхідному для олігомеризації [3], і один з яких знаходиться в ефекторному домені GTPase (GED) на C-кінці Drp1. Пряме ацилювання будь-якого з цих цистеїнів може викликати дефект активності Drp1 і, отже, лежить в основі впливу SFN на мітохондріальну динаміку. Примітно, що попередні роботи припускають, що дефекти олігомеризації та каталітичної активності можуть скасувати утримання Drp1 в мітохондріях [52]. Cys644 в домені GED є особливо привабливою мішенню на основі попередніх робіт, які показують, що мутація цього цистеїну фенокопіює мутації, які погіршують активність Drp1 GTPase [4], і що цей конкретний цистеїн модифікується тіол-реактивними електрофілами [9]. Вирішення цього невирішеного питання вимагатиме мас-спектрометричної перевірки. Таким чином, ми визначили нову цитопротекторну функцію для клінічно релевантної сполуки SFN. На додаток до активації головного антиоксидантного фактора транскрипції Nrf2, SFN сприяє злиттю мітохондрій і пероксисом, і цей ефект не залежить від Nrf2. Механізм, що лежить в основі цього явища, включає зниження функції GTPase Drp1, первинного медіатора мітохондріального та пероксисомного поділу. Основним наслідком SFN-опосередкованого злиття мітохондрій є те, що клітини стають стійкими до токсичних ефектів індуктора апоптозу стауроспорину. Ця додаткова цитопротекторна дія SFN може бути особливо корисною для численних нейродегенеративних захворювань, для яких вік є провідним фактором ризику (наприклад, хвороба Паркінсона, хвороба Альцгеймера, вікова макулярна дегенерація), оскільки ці захворювання були пов’язані з апоптозом і зменшували рівні та/або порушення регуляції Nrf2 [35], [36], [48].
Матеріали та методи
Аналіз апоптозу
Клітини висівали та трансфікували siRNA, як зазначено нижче. Клітини попередньо обробляли 50 мкМ сульфорафаном протягом 2 год, щоб індукувати злиття мітохондрій, а потім обробляли 1 мкМ стауроспорином для індукування апоптозу. Під час збору середовищі збирали в окремі пробірки та піддавали високошвидкісному центрифугування для осадження апоптотичних клітин. Цю клітинну гранулу об'єднували з прилиплими клітинами і розчиняли в 2-кратному концентрованому буфері Леммлі. Зразки піддавали вестерн-блоттингу проти PARP.
Генерація конструкцій CRISPR/Cas9
Щоб створити LentiCRISPR/eCas9 1.1, LentiCRISPR v2 (addgene #52961) спочатку було вирізано з Age1 і BamH1. Далі SpCas9 з eSpCas9 1.1 (addgene #71814) був ампліфікований ПЛР з Age1 і BamH1, використовуючи наступні праймери (прямий AGCGCACCGGTTCTAGAGCGCTGCCACCATGGACTATAAGGACCACGAC, зворотний AAGCGGACCACGAC, зворотний AAGCGGATCCCCTTGCC, розрізаний вищевказаний вектор на gTTGCGGATCCCGCTTCGTTGTTGTTGTTGTTG Послідовності sgRNA були визначені за допомогою Benchling.com. Параметри були встановлені так, щоб націлюватися на послідовність кодування з найвищими результатами на цільовому рівні та найнижчими позацільовими. Наступні послідовності (направл Юща послідовність підкреслені, HS sgNFE2L2 # 1 сенс CACCGCGACGGAAAGAGTATGAGC, антисмислового AAACGCTCATACTCTTTCCGTCGC; нд sgNFE2L2 # 2 сенсу CACCGGTTTCTGACTGGATGTGCT, антисмислової AAACAGCACATCCAGTCAGAAACC; нд sgNFE2L2 # 3 сенсу CACCGGAGTAGTTGGCAGATCCAC, антисмислової AAACGTGGATCTGCCAACTACTCC) відпалювали і лігували в BsmB1 вирізати LentiCRISPR / eCas9 1.1. Клітини RPE-1, інфіковані лентивірусом, відбирали за допомогою пуроміцину та підтримували у вигляді об’єднаної популяції. Нокаут був підтверджений імунофлюоресценцією та вестерн-блоттингом.
Культура клітин і трансфекції
Пігментні епітеліальні клітини сітківки сітківки людини, трансформовані теломеразою (RPE-1) (ATCC), культивували в модифікованому середовищі Дульбекко (DMEM), що містить 1 г/л глюкози, доповненої пеніциліном, стрептоміцином, 1X коктейлем незамінних амінокислот (Life Technologies), і 10% фетальної бичачої сироватки (Life Technologies). Для трансфекції siRNA 30,000 35,000–10 0.3 клітин/мл висівали протягом ночі. Клітини отримували 1 нМ siRNA, розведену в DMEM без сироватки та об’єднану з 2% реагентом для трансфекції інтерферину (PolyPlus). Для сенсибілізації апоптозу клітини отримували 3 нМ миРНК Bcl-XL. Клітини збирали через XNUMX дні після трансфекції.
Хімічні речовини, антитіла та олігомінельні РНК
Антитіла проти ?-тубуліну (Cell Signaling), ?-тубуліну (Sigma), Drp1 (BD Biosciences), KEAP1 (Proteintech), Lamin B1 (Abcam), PARP (Cell Signaling), PMP70 (Abcam) і Tom20 (BD Biosciences ) використовували в розведеннях 1:1000 для вестерн-блоттингу та для імунофлуоресценції. Власні кролячі антитіла анти-Nrf2 використовували о 1:2000 для вестерн-блоттингу [34], [59]. Сульфорафан (Sigma) і стауроспорин (Tocris) використовували при 50 мкМ і 1 мкМ відповідно. siRNA проти Drp1 (Dharmacon), Nrf2 (Dharmacon), KEAP1 (Cell Signaling) і Bcl-XL (Cell Signaling) використовували при 10 нМ, якщо не зазначено інше.
Імунофлуоресценція та маркування in vivo
Клітини, засіяні на покривних скель 18 мм, обробляли носієм або препаратом, фіксували в 3.7% формальдегіді і потім пермеабілізували в 0.2% Triton X-100/PBS на льоду протягом 10 хв. Первинні антитіла інкубували в 3% бичачого сироваткового альбуміну (BSA) у PBS протягом ночі при 4 °C. Після промивання PBS клітини інкубували протягом 1 години у відповідних видів, Alexa488- або Alexa546-, кон'югованих вторинних антитілах (розведених 1:1000) і 0.1 мкг/мл DAPI (Sigma) у 3% BSA/PBS. Мітохондрії візуалізували за допомогою імунофлуоресценції проти Tom20 або шляхом інкубації клітин у 200 нМ MitoTracker Red CMXRos (Molecular Probes, Inc.) у безсироватковій DMEM протягом 30 хвилин при 37 °C перед фіксацією.
Мікроскопія та аналіз зображень
Імунофлуоресцентні зразки розглядали на конфокальному мікроскопі LSM710 (Carl Zeiss). Мікрофотографії були зроблені за допомогою об’єктів з масляним зануренням 63X або 100X, а зображення були скориговані та покращені за допомогою Adobe Photoshop CS6. Аналіз спільної локалізації проводили з використанням функції спільної локалізації Carl Zeiss LSM710 з порогами, встановленими вручну, незважаючи на ідентичність зразків. Масштабні смуги на всьому протязі, якщо не вказано інше, становлять 10 м. Морфологію мітохондрій оцінювали шляхом сліпого оцінювання. Якщо мітохондрії клітини зберігалися як множинні круглі дискримінаційні точки, клітина оцінювалася як «розщеплення». Якщо окремі мітохондрії були нерозрізнені, а вся мітохондріальна мережа здавалася безперервною, клітина оцінювалася як «злиття». Усі інші клітини, включаючи ті з кластерними мітохондріями, були оцінені як «проміжні».
Субклітинні фракціонування
Клітини RPE-1 вирощували до злиття. Після промивання PBS клітини центрифугували при 600°g протягом 10 хв і ресуспендували в 600 мкл ізоляційного буфера (210 мМ манітол, 70 мМ сахароза, 5 мМ MOPS, 1 мМ EDTA pH 7.4+1 мМ PMSF). Суспензію лізували 30 разів у гомогенізаторі Dounce. Фракція гомогенату зберігалася як «лізат цільної клітини». Залишок піддавали центрифугування при 800°g протягом 10 хв до осадження ядер. Супернатанти піддавали центрифугування при 1500°g протягом 10 хв для очищення залишилися ядер і нелізованих клітин. Цей супернатант піддавали центрифугування при 15,000ºg протягом 15 хв для осадження мітохондрій. Супернатант зберігали у вигляді «цитозольної фракції». Осад обережно промивали PBS і ресуспендували в ізоляційному буфері. Концентрацію білка в кожній фракції вимірювали за допомогою аналізу біцинхонинової кислоти (BCA), а еквівалентні кількості білка розділяли за допомогою SDS-PAGE.
Вестерн Блотінг
Клітини промивали в PBS і розчиняли в 2-кратному концентрованому розчинному буфері Леммлі (100 мМ Трис [pH 6.8], 2% SDS, 0.008% бромфенолового синього, 2% 2-меркаптоетанолу, 26.3% гліцерину і 0.001% PYO). Лізати кип’ятили протягом 5 хв перед завантаженням у поліакриламідні гелі додецилсульфату натрію (SDS). Білки переносили на нітроцелюлозні мембрани, і мембрани блокували на 1 годину в 5% молоці/TBST. Первинні антитіла розводили у 5% молоці/TBST та інкубували з блоттингом протягом ночі при 4 °C. Вторинні антитіла, кон’юговані з пероксидазою хрону (HRP), розводили в 5% молоці/TBST. Блоти були оброблені з посиленою хемілюмінесценцією, а денситометричні кількісні оцінки проводили за допомогою програмного забезпечення ImageJ.

Сульфорафан — це хімічна речовина із ізотіоціанатної колекції сіркоорганічних речовин, одержуваних із овочів хрестоцвітних, включаючи брокколі, капусту, цвітну капусту, капусту та капусту, серед інших. Сульфорафан утворюється, коли фермент мирозиназа перетворює глюкорафанін, глюкозинолат, у сульфорафан, також відомий як сульфорафан-глюкозинолат. Паростки брокколі та цвітна капуста мають найвищу концентрацію глюкорафаніну або попередника сульфорафану. Дослідження показали, що сульфорафан підвищує антиоксидантні властивості людського організму для запобігання різних проблем зі здоров’ям. Д-р Алекс Хіменес, округ Колумбія, CCST Insight
Сульфорафан та його вплив на рак, смертність, старіння, мозок і поведінку, хвороби серця тощо
Ізотіоціанати є одними з найважливіших рослинних сполук, які ви можете отримати у своєму раціоні. У цьому відео я роблю для них найповнішу справу, яку коли-небудь робили. Короткий період уваги? Перейдіть до улюбленої теми, натиснувши один із моментів часу нижче. Повна хронологія нижче.
Ключові розділи:
- 00:01:14 – Рак і смертність
- 00:19:04 – Старіння
- 00:26:30 – Мозок і поведінка
- 00:38:06 – Підсумок
- 00:40:27 – Доза
Повний графік:
- 00:00:34 – Представлення сульфорафану, головна тема відео.
- 00:01:14 – Споживання овочів хрестоцвітних і зниження смертності від усіх причин.
- 00:02:12 – Ризик раку передміхурової залози.
- 00:02:23 – Ризик раку сечового міхура.
- 00:02:34 – Ризик раку легенів у курців.
- 00:02:48 – Ризик раку молочної залози.
- 00:03:13 – Гіпотетична: що робити, якщо у вас уже рак? (інтервенційний)
- 00:03:35 – Імовірний механізм, який керує асоціативними даними раку та смертності.
- 00:04:38 – Сульфорафан і рак.
- 00:05:32 – Докази на тваринах, що показують сильний вплив екстракту паростків брокколі на розвиток пухлин сечового міхура у щурів.
- 00:06:06 – Вплив прямого прийому сульфорафану у пацієнтів з раком передміхурової залози.
- 00:07:09 – Біоакумуляція метаболітів ізотіоціаната у фактичній тканині молочної залози.
- 00:08:32 – Пригнічення стовбурових клітин раку молочної залози.
- 00:08:53 – Урок історії: ще в Стародавньому Римі стверджували, що капустяні гриби мають оздоровчі властивості.
- 00:09:16 – Здатність сульфорафану посилювати виведення канцерогену (бензолу, акролеїну).
- 00:09:51 – NRF2 як генетичний перемикач через елементи антиоксидантної реакції.
- 00:10:10 – Як активація NRF2 посилює виведення канцерогену через глутатіон-S-кон'югати.
- 00:10:34 – Брюссельська капуста підвищує глутатіон-S-трансферазу і зменшує пошкодження ДНК.
- 00:11:20 – Напій з проростків брокколі збільшує виведення бензолу на 61%.
- 00:13:31 – Гомогенат паростків брокколі підвищує антиоксидантні ферменти у верхніх дихальних шляхах.
- 00:15:45 – Споживання хрестоцвітних овочів і смертність від серцево-судинних захворювань.
- 00:16:55 – порошок паростків брокколі покращує рівень ліпідів у крові та загальний ризик серцевих захворювань у діабетиків 2 типу.
- 00:19:04 – Початок секції старіння.
- 00:19:21 – Дієта, збагачена сульфорафаном, збільшує тривалість життя жуків від 15 до 30% (за певних умов).
- 00:20:34 – Важливість слабкого запалення для довголіття.
- 00:22:05 – Овочі хрестоцвітних і порошок паростків брокколі, здається, зменшують широкий спектр запальних маркерів у людей.
- 00:23:40 – Підсумок у середині відео: розділи про рак, старіння
- 00:24:14 – Дослідження на мишах показують, що сульфорафан може покращити адаптивну імунну функцію в літньому віці.
- 00:25:18 – Сульфорафан покращив ріст волосся у мишачої моделі облисіння. Зображення на 00:26:10.
- 00:26:30 – Початок розділу «Мозок і поведінка».
- 00:27:18 – Вплив екстракту паростків брокколі на аутизм.
- 00:27:48 – Вплив глюкорафаніну на шизофренію.
- 00:28:17 – Початок обговорення депресії (правдоподібний механізм та дослідження).
- 00:31:21 – Дослідження на мишах з використанням 10 різних моделей депресії, викликаної стресом, показало, що сульфорафан так само ефективний, як і флуоксетин (прозак).
- 00:32:00 – Дослідження показує, що пряме вживання глюкорафаніну мишами так само ефективне для запобігання депресії через модель стресу соціальної поразки.
- 00:33:01 – Початок відділу нейродегенерації.
- 00:33:30 – Сульфорафан і хвороба Альцгеймера.
- 00:33:44 – Сульфорафан і хвороба Паркінсона.
- 00:33:51 – Сульфорафан і хвороба Хантінгтона.
- 00:34:13 – Сульфорафан збільшує кількість білків теплового шоку.
- 00:34:43 – Початок секції черепно-мозкової травми.
- 00:35:01 – Сульфорафан, введений відразу після ЧМТ, покращує пам’ять (дослідження на мишах).
- 00:35:55 – Сульфорафан і нейрональна пластичність.
- 00:36:32 – Сульфорафан покращує навчання на моделі діабету ІІ типу у мишей.
- 00:37:19 – Сульфорафанова і м’язова дистрофія Дюшенна.
- 00:37:44 – Інгібування міостатину в клітинах-супутниках м’язів (in vitro).
- 00:38:06 – Пізнє відео: смертність і рак, пошкодження ДНК, окислювальний стрес і запалення, виділення бензолу, серцево-судинні захворювання, діабет ІІ типу, вплив на мозок (депресія, аутизм, шизофренія, нейродегенерація), шлях NRF2.
- 00:40:27 – Думки щодо визначення дози паростків брокколі або сульфорафану.
- 00:41:01 – Анекдоти про проростання в домашніх умовах.
- 00:43:14 – Про температуру приготування та активність сульфорафану.
- 00:43:45 – Перетворення сульфорафану з глюкорафаніну кишковими бактеріями.
- 00:44:24 – Добавки працюють краще в поєднанні з активною мирозиназою з овочів.
- 00:44:56 – Техніка приготування та овочі хрестоцвітних.
- 00:46:06 – Ізотіоціанати як зоб.
Подяки
Sciencedirect.com/science/article/pii/S2213231716302750
Як виробляється сульфорафан?
Нагрівання зменшує активність білка епітіоспецифічного білка та збільшує утворення сульфорафану в брокколі
абстрактний
Сульфорафан, ізотіоціанат з брокколі, є одним з найпотужніших антиканцерогенів харчового походження. Ця сполука не присутня в неушкодженому овочі, вона утворюється з його попередника глюкозинолату, глюкорафаніну, під дією мірозинази, ферменту тіоглюкозидази, коли тканину брокколі подрібнюють або жують. Проте низка досліджень продемонструвала, що вихід сульфорафану з глюкорафаніну низький, і що небіологічно активний аналог нітрилу, сульфорафаннітрил, є основним продуктом гідролізу при подрібненні рослинної тканини при кімнатній температурі. Останні дані свідчать про те, що у арабідопсису утворення нітрилу з глюкозинолатів контролюється термочутливим білком, епітіоспецифічним білком (ESP), некаталітичним кофактором мірозинази. Наші цілі полягали в тому, щоб вивчити вплив нагрівання суцвіть і паростків брокколі на утворення сульфорафану та сульфорафанового нітрилу, визначити, чи містить брокколі активність ESP, а потім корелювати зміни в активності ESP, вмісту сульфорафану та біоактивності, що залежать від тепла, виміряні індукцією фаза II детоксикаційного ферменту хінонредуктази (QR) у культурі клітин. Нагрівання свіжих суцвіть брокколі або паростків брокколі до 60 °C перед гомогенізацією одночасно збільшує утворення сульфорафану та зменшує утворення сульфорафанового нітрилу. Значна втрата активності ESP паралельно зі зменшенням утворення сульфорафанового нітрилу. Нагрівання до 70 °C і вище зменшувало утворення обох продуктів у суцвіттях брокколі, але не в паростках брокколі. Індукція QR у культивованих клітинах гепатоми Hepa lclc7 миші одночасно збільшує утворення сульфорафану.

Попереднє нагрівання суцвіть і паростків брокколі до 60 °C значно підвищило каталізоване мирозиназою утворення сульфорафану (SF) в екстрактах рослинної тканини після подрібнення. Це було пов’язано зі зниженням утворення сульфорафанового нітрилу (SF Nitrile) та активності епітіоспецифічного білка (ESP).
Ключові слова: Брокколі, Brassica oleracea, Cruciferae, Cancer, Anticarcinogen, Sulforaphane, Sulforaphane nitrile, Epithiospecifier білка, хінонередуктази
На закінчення можна сказати, що сульфорафан є фітохімічною речовиною, яка міститься в брокколі та інших овочах хрестоцвітних. Неконтрольована кількість окислювачів, викликана як внутрішніми, так і зовнішніми факторами, може викликати окислювальний стрес в організмі людини, що в кінцевому підсумку може призвести до різноманітних проблем зі здоров’ям. Сульфорафан може активувати вироблення Nrf2, фактора транскрипції, який допомагає регулювати захисні антиоксидантні механізми, які контролюють реакцію клітини на окислювачі. Обсяг нашої інформації обмежено хіропрактикою та проблемами здоров’я хребта. Щоб обговорити тему, зверніться до доктора Хіменеса або зв’яжіться з нами за адресою�915-850-0900.
Куратор доктор Алекс Хіменес
Посилання з: Sciencedirect.com

Додаткова тема для обговорення: «Гострий біль у спині».
Біль у спині� є однією з найпоширеніших причин інвалідності та пропущених робочих днів у всьому світі. Біль у спині є другою за поширеністю причиною відвідувань лікаря, переважаючи лише інфекції верхніх дихальних шляхів. Приблизно 80 відсотків населення відчувають біль у спині хоча б раз у житті. Хребет – це складна структура, що складається з кісток, суглобів, зв’язок і м’язів, серед інших м’яких тканин. Через це травми та/або загострення стану, такі як�грижі диски, може зрештою призвести до симптомів болю в спині. Спортивні травми або травми в автомобільній катастрофі часто є найчастішою причиною болю в спині, однак іноді найпростіші рухи можуть мати хворобливі наслідки. На щастя, альтернативні варіанти лікування, такі як хіропрактика, можуть допомогти полегшити біль у спині за допомогою корекції хребта та ручних маніпуляцій, що в кінцевому підсумку покращує полегшення болю.

ЕКСТРА ДОДАТКО | ВАЖЛИВА ТЕМА: Рекомендований хіропрактик в Ель-Пасо, штат Техас
***
Інформація в цьому документі на "Що таке сульфорафан?" не призначений для заміни особистих стосунків із кваліфікованим медичним працівником або ліцензованим лікарем і не є медичною консультацією. Ми заохочуємо вас приймати рішення щодо охорони здоров’я на основі ваших досліджень і партнерства з кваліфікованим медичним працівником.
Інформація в блозі та обговорення обсягу
Наша інформаційна сфера обмежується хіропрактикою, опорно-руховим апаратом, фізичними препаратами, оздоровленням, що сприяє етіологічному вісцеросоматичні порушення у клінічних презентаціях, клінічній динаміці асоційованого соматовісцерального рефлексу, комплексах підвивиху, чутливих питаннях здоров’я та/або статей, темах та дискусіях з функціональної медицини.
Надаємо та презентуємо клінічне співробітництво з фахівцями різних галузей. Кожен фахівець керується своєю професійною сферою практики та юрисдикцією ліцензування. Ми використовуємо протоколи функціонального здоров’я та оздоровлення для лікування та підтримки догляду за травмами або розладами опорно-рухового апарату.
Наші відео, дописи, теми, предмети та висновки охоплюють клінічні питання, проблеми та теми, які стосуються та прямо чи опосередковано підтримують нашу клінічну практику.*
Наш офіс обґрунтовано намагався надати підтверджувальні цитати та визначив відповідне дослідження або дослідження, що підтверджують наші публікації. За запитом ми надаємо копії допоміжних наукових досліджень, доступні регуляторним комісіям та громадськості.
Ми розуміємо, що ми розглядаємо питання, які потребують додаткового пояснення того, як це може допомогти в певному плані догляду або протоколі лікування; тому для подальшого обговорення вищезазначеної теми, будь ласка, не соромтеся запитувати Доктор Алекс Хіменес, округ Колумбія, Або зв'яжіться з нами за адресою 915-850-0900.
Ми тут, щоб допомогти вам та вашій родині.
Благословення
Д-р Алекс Хіменес Постійного струму, MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
електронна пошта: coach@elpasofunctionalmedicine.com
Ліцензія доктора хіропрактики (DC) у Техас & Нью-Мексико*
Техас, округ Колумбія, номер ліцензії TX5807, Нью-Мексико, округ Колумбія Номер ліцензії NM-DC2182
Ліцензія дипломованої медсестри (RN*) in Флорида
Ліцензія Флориди Ліцензія RN # RN9617241 (Контрольний номер 3558029)
Компактний статус: Мультидержавна ліцензія: Уповноважений на практику в Стани 40*
Доктор Алекс Хіменес, округ Колумбія, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Моя цифрова візитна картка






