1. ХТО. ХТО | Надмірна вага і ожиріння. www.who.int/gho/ncd/
risk_factors/overweight/en/index.html. Доступ 29 січня 2015 року.
2. Visscher PM, Brown MA, McCarthy MI, Yang J. П'ять років відкриття GWAS.
Am J Hum Genet. 2012;90:7�24.
3. Локк А.Е., Кахалі Б., Берндт С.І., Джастис А.Е., Перс Т.Х., Дей Ф.Р. та ін. Генетичний
дослідження індексу маси тіла дають нове розуміння біології ожиріння. природа.
2015;518:197.
4. Лінг C, Del Guerra S, Lupi R, Rnnn T, Granhall C, Luthman H та ін.
Епігенетична регуляція PPARGC1A на діабетичних острівцях 2 типу людини та
вплив на секрецію інсуліну. Діабетологія. 2008;51:615�22.
5. Ван Дейк SJ, Molloy PL, Varinli H, Morrison JL, Muhlhausler BS. Епігенетика
і ожиріння людини. Int J Obes (Лонд). 2015;39:85�97.
6. Тех А.Л., Пан Х., Чен Л., Онг М.Л., Догра С., Вонг Дж. та ін. Ефект від
генотип і внутрішньоутробне середовище на міжіндивідуальних варіаціях у новонароджених
ДНК-метиломи. Геном Res. 2014;24:1064�74.
7. Olsson AH, Volkov P, Bacos K, Dayeh T, Hall E, Nilsson EA та ін. Усього генома
асоціації між впливом генетичної та епігенетичної варіацій
Експресія мРНК та секреція інсуліну на острівцях підшлункової залози людини. PLoS
Жене. 2014;10:e1004735.
8. Grundberg E, Meduri E, Sandling JK, Hedman AK, Keildson S, Buil A та ін.
Глобальний аналіз варіації метилювання ДНК у жировій тканині близнюків
виявляє зв’язки з асоційованими з хворобою варіантами дистальних регуляторних елементів.
Am J Hum Genet. 2013;93:876�90.
9. Ронн Т., Волков П., Гіллберг Л., Кокосар М., Перфільєв А., Якобсен А.Л. та ін.
Вплив віку, рівня ІМТ та HbA1c на всю геномну ДНК
моделі метилювання та експресії мРНК в жировій тканині людини
і ідентифікація епігенетичних біомаркерів у крові. Hum Mol Genet.
2015;24:3792.
10. Уотерленд Р.А., Міхельс К.Б. Епігенетична епідеміологія розвитку
гіпотеза походження. Annu Rev Nutr. 2007;27:363�88.
11. МакМіллен IC, Rattanatray L, Duffield JA, Morrison JL, MacLaughlin SM, Gentili
S та ін. Ранні витоки пізнішого ожиріння: шляхи та механізми. присл
Exp Med Biol. 2009;646:71.
12. Ravelli A, van der Meulen J, Michels R, Osmond C, Barker D, Hales C та ін.
Толерантність до глюкози у дорослих після пренатального впливу голоду. Ланцет.
1998;351:173.
13. Макміллен IC, MacLaughlin SM, Muhlhausler BS, Gentili S, Duffield JL,
Моррісон Дж.Л. Витоки розвитку здоров'я і хвороб дорослих: роль
периконцепційне та фетальне харчування. Basic Clin Pharmacol Toxicol.
2008;102:82.
14. Чжан С., Раттанатрей Л., МакМіллен І.С., Сутер К.М., Моррісон Дж.Л. Періконцепційний
харчування та раннє програмування життя з ожирінням або негараздами. Prog
Biophys Mol Biol. 2011;106:307�14.
15. Буре С., Левін Б.Є., Озанн С.Є. Контроль взаємодій ген-середовище
енергетичний і глюкозний гомеостаз і причини розвитку ожиріння.
Physiol Rev. 2015; 95:47�82.
16. Borengasser SJ, Zhong Y, Kang P, Lindsey F, Ronis MJ, Badger TM та ін.
Ожиріння матері посилює диференціацію білої жирової тканини і змінює її
Метилювання ДНК в масштабі генома у потомства самців щурів. Ендокринологія.
2013;154:4113.
17. Глюкман П.Д., Ліллікроп К.А., Вікерс М.Х., Плезантс А.Б., Філіпс Е.С., Бідл А.С.,
та ін. Метаболічна пластичність під час розвитку ссавців спрямована
залежно від раннього стану харчування. Proc Natl Acad Sci США А.
2007;104:12796.
18. Годфрі К.М., Шеппард А., Глюкман П.Д., Ліллікроп К.А., Бердж Г.К., Маклін К.,
та ін. Метилювання промотору епігенетичного гена при народженні пов’язане з
пізніше ожиріння дитини. цукровий діабет. 2011;60:1528�34.
19. Макміллен IC, Адам CL, Muhlhausler BS. Ранні причини ожиріння:
програмування системи регулювання апетиту. J Physiol. 2005; 565 (Ч. 1): 9�17.
20. Бегум Г., Стівенс А., Сміт Е.Б., Коннор К., Чалліс Дж.Р., Блумфілд Ф. та ін.
Епігенетичні зміни в шляхах регуляції енергії гіпоталамуса плода
пов'язані з недостатнім харчуванням матері та двойнятами. ФАСЕБ Дж.
2012;26:1694.
21. Ge ZJ, Liang QX, Hou Y, Han ZM, Schatten H, Sun QY та ін. Ожиріння матері
і цукровий діабет може викликати зміну метилювання ДНК у сперматозоїдах
потомство у мишей. Репрод Біол Ендокринол. 2014;12:29.
22. Jousse C, Parry L, Lambert-Langlais S, Maurin AC, Averous J, Bruhat A та ін.
Перинатальне недоїдання впливає на метилювання та експресію лептину
ген у дорослих: значення для розуміння метаболічного синдрому.
FASEB J. 2011;25:3271�8.
23. Lan X, Cretney EC, Kropp J, Khateeb K, Berg MA, Penagaricano F та ін.
Дієта матері під час вагітності викликає експресію генів і ДНК
зміни метилювання в тканинах плода у овець. Front Genet. 2013;4:49.
24. Li CC, Young PE, Maloney CA, Eaton SA, Cowley MJ, Buckland ME та ін.
Ожиріння матері та цукровий діабет викликають приховані метаболічні дефекти і
поширені епігенетичні зміни у ізогенних мишей. Епігенетика. 2013;8:602�11.
25. Lillycrop KA, Phillips ES, Jackson AA, Hanson MA, Burdge GC. Дієтичний білок
обмеження вагітних щурів викликає, а прийом фолієвої кислоти запобігає
епігенетична модифікація експресії печінкових генів у потомства. J Nutr.
2005;135:1382.
26. Редфорд EJ, Ito M, Shi H, Corish JA, Yamazawa K, Isganaitis E та ін. Внутріутробно
ефектів. Внутрішньоутробне недоїдання порушує метилом сперматозоїдів дорослих
і обмін речовин між поколіннями. наук. 2014;345(80):1255903.
27. Suter M, Bocock P, Showalter L, Hu M, Shope C, McKnight R та ін.
Епігеноміка: вплив материнської дієти з високим вмістом жирів у внутрішньоутробному періоді порушує
експресія периферійних циркадних генів у нелюдських приматів. ФАСЕБ Дж.
2011;25:714.
28. Suter MA, Ma J, Vuguin PM, Hartil K, Fiallo A, Harris RA та ін. Внутріутробно
вплив материнської дієти з високим вмістом жирів змінює епігенетичний гістоновий код у a
мишача модель. Am J Obs Gynecol. 2014;210:463 e1�463 e11.
29. Tosh DN, Fu Q, Callaway CW, McKnight RA, McMillen IC, Ross MG та ін.
Епігенетика програмованого ожиріння: зміна IUGR печінкового IGF1 щурів
експресія мРНК і структура гістонів у швидкому або відстроченому постнатальному періоді
наздоганяє зростання. Am J Physiol Gastrointest Fiziol печінки.
2010;299:G1023�9.
30. Сандовічі І, Сміт Н.Х., Нітерт М.Д., Акерс-Джонсон М., Урібе-Льюїс С., Іто Ю.,
та ін. Дієта матері та старіння змінюють епігенетичний контроль підсилювача
взаємодія гена Hnf4a в острівцях підшлункової залози щурів. Proc Natl
Acad Sci US A. 2011; 108:5449�54.
31. Брауншвейг М., Джаганнатан В., Гутцвіллер А., Бі Г. Дослідження щодо
трансгенераційна епігенетична відповідь по чоловічій лінії у свиней F2. PLoS
один. 2012; 7, e30583.
32. Carone BR, Fauquier L, Habib N, Shea JM, Hart CE, Li R та ін. По-батьківськи
індукована трансгенераційна екологічна перепрограмування метаболізму
експресія генів у ссавців. клітинка. 2010;143:1084�96.
33. Ost A, Lempradl A, Casas E, Weigert M, Tiko T, Deniz M та ін. Батьківська дієта
визначає стан хроматину нащадків і ожиріння між поколіннями. клітинка.
2014;159:1352.
34. Мартинес Д., Пентінат Т., Ріб С., Давіо К., Блокс В. В., Себрі Дж. та ін. Внутріутробно
недостатнє харчування у самців мишей програмує печінковий ліпідний обмін у другому поколінні
потомство, що включає змінене метилювання ДНК Lxra. Клітинний метаб.
2014;19:941.
35. Wei Y, Yang CR, Wei YP, Zhao ZA, Hou Y, Schatten H та ін. По-батьківськи
індукована трансгенераційна спадковість схильності до цукрового діабету в
ссавці. Proc Natl Acad Sci US A. 2014;111:1873�8.
36. Гроссніклаус У, Келлі Р.Г., Келлі Б., Фергюсон-Сміт А.С., Пембрі М., Ліндквіст
С. Трансгенераційне епігенетичне успадкування: наскільки це важливо? Nat Rev
Жене. 2013;14:228�35.
37. Пембрі М., Саффері Р., Бігрен Л.О. Трансгенераційні реакції людини на
досвід раннього життя: потенційний вплив на розвиток, здоров’я та
біомедичні дослідження. J Med Genet. 2014;51:563�72.
38. Wolff GL, Kodell RL, Moore SR, Cooney CA. Епігенетика матері та метил
добавки впливають на експресію гена агуті у мишей Avy/a. ФАСЕБ Дж.
1998;12:949.
39. Джиртл Р.Л., Скіннер М.К. Епігеноміка навколишнього середовища та сприйнятливість до захворювань.
Nat Rev Genet. 2007; 8: 253.
40. Morgan HD, Sutherland HG, Martin DI, Whitelaw E. Епігенетична спадковість у
локус агуті у миші. Нат Жене. 1999;23:314�8.
41. Кроплі JE, Suter CM, Beckman KB, Martin DI. Епігенетична зародкова лінія
модифікація мишачого алеля A vy шляхом харчових добавок. Proc
Natl Acad Sci US A. 2006;103:17308�12.
42. Hoile SP, Lillycrop KA, Thomas NA, Hanson MA, Burdge GC. Дієтичний білок
обмеження під час вагітності F0 у щурів викликає трансгенераційні зміни в
печінковий транскриптом у нащадків жіночої статі. PLoS One. 2011; 6, e21668.
43. Multhaup ML, Seldin MM, Jaffe AE, Lei X, Kirchner H, Mondal P та ін. Мишалюдина
експериментальний епігенетичний аналіз розкриває дієтичні цілі та
генетична схильність до діабетичних фенотипів. Клітинний метаб. 2015;21:138�49.
44. Michels KB, Binder AM, Dedeurwaerder S, Epstein CB, Greally JM, Gut I та ін.
Рекомендації щодо проектування та аналізу епігенома в цілому
дослідження асоціацій. Методи Nat. 2013;10:949�55.
45. Dayeh TA, Olsson AH, Volkov P, Almgren P, Rnnn T, Ling C. Ідентифікація
CpG-SNP, пов'язані з діабетом 2 типу та диференціальним метилюванням ДНК
на острівцях підшлункової залози людини. Діабетологія. 2013;56:1036�46.
46. Релтон К.Л., Дейві Сміт Г. Двоетапна епігенетична менделівська рандомізація: a
стратегія встановлення причинно-наслідкової ролі епігенетичних процесів у шляхах
до хвороби. Int J Epidemiol. 2012;41:161�76.
47. Liu Y, Aryee MJ, Padyukov L, Fallin MD, Hesselberg E, Runarsson A та ін.
Дані про асоціацію в епігеномі вказують на метилювання ДНК як
посередник генетичного ризику при ревматоїдному артриті. Nat Biotechnol.
2013;31:142.
48. Yuan W, Xia Y, Bell CG, Yet I, Ferreira T, Ward KJ та ін. Інтегрований
Епігеномний аналіз локусів чутливості до цукрового діабету 2 типу у монозиготних
близнюки. Nat Commun. 2014;5:5719.
49. Nitert MD, Dayeh T, Volkov P, Elgzyri T, Hall E, Nilsson E та ін. Вплив an
вправи на метилювання ДНК у скелетних м’язах з першого ступеня
родичі хворих на цукровий діабет 2 типу. цукровий діабет. 2012;61:3322�32.
50. Ганьон Ф., Ассі Д., Каррі А., Моранж П.Е., Трегут Д.А. Надійна перевірка
Асоціація рівнів метилювання в локусі CPT1A з рівнями ліпідів у плазмі.
J Lipid Res. 2014;55:1189.
51. Демерат Е.В., Гуан В., Гроув М.Л., Аслібекян С., Мендельсон М., Чжоу Ю.Х.,
та ін. Епігеномне дослідження асоціації (EWAS) ІМТ, зміни ІМТ та
окружність талії у дорослих афроамериканців ідентифікує множинні реплікації
локуси. Hum Mol Genet. 2015:ddv161�.
52. Дік К. Дж., Нельсон С. П., Цапроуні Л., Сандлінг Дж. К., Ассі Д., Уол С. та ін. ДНК
метилювання та індекс маси тіла: аналіз усього геному. Ланцет.
2014;6736:1.
53. Su S, Zhu H, Xu X, Wang X, Dong Y, Kapuku G та ін. Метилювання ДНК
ген LY86 асоціюється з ожирінням, інсулінорезистентністю та
запалення. Twin Res Hum Genet. 2014;17:183�91.
54. Кларк-Харріс Р., Уілкін Т.Д., Хоскінг Дж., Пінкні Дж., Джеффрі А.Н., Меткалф Б.С. та ін.
PGC1? метилювання промотора в крові у 5 років прогнозує ожиріння від
Від 9 до 14 років (EarlyBird 50). цукровий діабет. 2014;63:2528�37.
55. Guay SP, Brisson D, Lamarche B, Biron S, Lescelleur O, Biertho L та ін.
Метилювання ДНК промотора гена ADRB3 в крові та вісцеральному жирі
тканини пов’язано з порушенням обміну речовин у чоловіків. Епігеноміка.
2014;6:33.
56. Agha G, Houseman EA, Kelsey KT, Eaton CB, Buka SL, Loucks EB. Ожиріння є
пов'язаний з профілем метилювання ДНК в жировій тканині. Int J Epidemiol.
2014: 1�11.
57. Irvin MR, Zhi D, Joehanes R, Mendelson M, Aslibekyan S, Claas SA та ін.
Епігеномне дослідження ліпідів крові натще в генетиці
Ліпідознижувальні препарати та мережеве дослідження дієти. Тираж. 2014;130:565�72.
58. Frazier-Wood AC, Aslibekyan S, Absher DM, Hopkins PN, Sha J, Tsai MY та ін.
Метилування в локусі CPT1A пов’язане з субфракцією ліпопротеїнів
профілі. J Lipid Res. 2014;55:1324�30.
59. Pfeifferm L, Wahl S, Pilling LC, Reischl E, Sandling JK, Kunze S та ін. ДНК
метилювання генів, пов’язаних з ліпідами, впливає на рівень ліпідів у крові. Circ Cardiovasc
Genet. 2015 рік.
60. Петерсен А.К., Цайлінгер С., Кастенмюллер Г., Ріміш-Маргл В., Бруггер М., Петерс
A та ін. Епігенетика зустрічається з метаболомікою: епігеномна асоціація
дослідження метаболічних властивостей сироватки крові. Hum Mol Genet. 2014;23:534�45.
61. Ідальго Б., Ірвін М.Р., Ша Дж., Жі Д., Аслібекян С., Абшер Д. та ін. Епігеномний
асоціаційне дослідження показників глюкози, інсуліну та HOMA-IR натще
у генетиці ліпідознижувальних препаратів та дослідженні мережі дієт. цукровий діабет.
2014;63:801.
62. Dayeh T, Volkov P, Sal� S, Hall E, Nilsson E, Olsson AH та ін. По всьому геному
Аналіз метилювання ДНК острівців підшлункової залози людини від діабетика 2 типу
а донори без діабету визначають гени-кандидати, які впливають на інсулін
секреція. PLoS Genet. 2014;10, e1004160.
63. Нільссон Е., Янссон П.А., Перфілєв А., Волков П., Педерсен М., Свенссон М.К. та ін.
Вплив зміненого метилювання ДНК та диференційної експресії генів
метаболізм і запалення в жировій тканині у суб'єктів з типом 2
цукровий діабет. цукровий діабет. 2014;63:2962�76.
64. Бентон MC, Джонстон A, Eccles D, Harmon B, Hayes MT, Lea RA та ін. Аналіз метилювання ДНК у жировій тканині людини виявляє диференційну модифікацію генів ожиріння до та після шунтування шлунка та ваги
втрати. ген. 2015;16:1�21.
65. Бейтсон П., Глюкман П. Пластичність і міцність у розвитку і
еволюція. Int J Epidemiol. 2012;41:219�23.
66. Фейнберг А.П., Ірізаррі Р.А., Фейнберг А.П., Ірізаррі Р.А. Еволюція здоров'я і
Медицина Саклера колоквіум: стохастична епігенетична варіація як рушійна сила
сила розвитку, еволюційна адаптація і хвороба. Proc Natl Acad
Sci US A. 2010; 107 (додаток): 1757�64.
67. Мартіно Д., Локе Ю. Дж., Гордон Л., Оллікайнен М., Круікшенк М. Н., Саффері Р. та ін.
Поздовжній, геномний аналіз метилювання ДНК у близнюків від народження
до 18-місячного віку виявляє швидкі епігенетичні зміни в ранньому віці і парноспецифічні
наслідки розбіжності. Геном біол. 2013;14:R42.
68. Тобі EW, Goeman JJ, Monajemi R, Gu H, Putter H, Zhang Y та ін. ДНК
Сигнатури метилювання пов’язують пренатальний голод із зростанням і
обмін речовин. Nat Commun. 2014;5:5592.
69. Dominguez-Salas P, Moore SE, Baker MS, Bergen AW, Cox SE, Dyer RA та ін.
Харчування матері під час зачаття модулює метилювання ДНК людини
метастабільні епіалели. Nat Commun. 2014;5:3746.
70. Quilter CR, Cooper WN, Cliffe KM, Skinner BM, Prentice PM, Nelson L та ін.
Вплив гестаційного діабету матері на моделі метилювання нащадків
mellitus і внутрішньоутробне уповільнення розвитку свідчать про загальні гени і
шляхи, пов’язані з подальшим ризиком цукрового діабету 2 типу. FASEB J. 2014: 1�12.
71. Моралес E, Groom A, Lawlor DA, Relton CL. Сигнатури метилювання ДНК в
пуповинна кров, пов’язана із збільшенням ваги матері під час вагітності: результати від
когорта ALSPAC. Примітки BMC Res. 2014;7:278.
72. Ruchat SM, Houde AA, Voisin G, St-Pierre J, Perron P, Baillargeon JP та ін.
Гестаційний цукровий діабет епігенетично впливає переважно на гени
бере участь у захворюваннях обміну речовин. Епігенетика. 2013;8:935�43.
73. Лю Х, Чен К, Цай ХДжей, Ван Г, Хун Х, Чжоу Ю та ін. Материнська
індекс маси тіла до зачаття та ДНК нащадків пуповинної крові
метилювання: дослідження ранніх джерел захворювання. Environ Mol
Мутаген. 2014;55:223�30.
74. Soubry A, Murphy SK, Wang F, Huang Z, Vidal AC, Fuemmeler BF та ін.
У новонароджених батьків з ожирінням змінилися моделі метилювання ДНК
імпринтовані гени. Int J Obes (Лонд). 2015;39:650�7.
75. Jacobsen SC, Brøns C, Bork-Jensen J, Ribel-Madsen R, Yang B, Lara E та ін.
Вплив короткочасного перегодовування з високим вмістом жиру на ДНК всього геному
метилювання в скелетних м'язах здорових молодих чоловіків. Діабетологія.
2012;55:3341.
76. Gillberg L, Jacobsen SC, R�nn T, Br�ns C, Vaag A. PPARGC1A ДНК
метилювання в підшкірно-жировій клітковині у суб'єктів з низькою масою тіла при народженні
вплив 5-денного перегодовування з високим вмістом жиру. Обмін речовин. 2014;63:263�71.
77. Huang YT, Maccani JZJ, Hawley NL, Wing RR, Kelsey KT, McCaffery JM.
Епігенетичні моделі в успішних підтримувачів втрати ваги: пілотне дослідження. Інт Дж
Обес (Лонд). 2015;39:865�8.
78. Баррес Р., Кіршнер Х., Расмуссен М., Ян Дж., Кантор Ф.Р., Крук А., Нслунд Е.,
Зіерат молодший Втрата ваги після операції шунтування шлунка при ожирінні людини
ремоделює промотор метилювання. Відповідь клітини 2013: 1�8.
79. Аренс М., Аммерполь О., фон Шенфельс В., Коларова Дж., Бенс С., Іцель Т. та ін.
Аналіз метилювання ДНК при неалкогольній жировій хворобі печінки свідчить про те
чіткі ознаки специфічного захворювання та ремоделювання після баріатричної хірургії.
Клітинний метаб. 2013;18:296�302.
80. Voisin S, Eynon N, Yan X, Bishop DJ. Вправи та метилювання ДНК
у людей. Acta Physiol (Oxf). 2014;213:39�59.
81. Ліндхольм М.Є., Марабіта Ф., Гомес-Кабреро Д., Рундквіст Х., Екстрм Т.Д.,
Tegn'r J та ін. Інтегративний аналіз виявляє скоординоване перепрограмування
епігенома та транскриптому в скелетних м’язах людини після
навчання. Епігенетика. 2014;9:1557�69.
82. Денхем Дж., О. Брайен Б. Дж., Маркес Ф. З., Чарчар Ф. Дж. Зміни лейкоцитів
метилом та його вплив на серцево-судинні гени після тренування.
J Appl Physiol. 2014: jap.00878.2014.
83. Rowlands DS, Page RA, Sukala WR, Giri M, Ghimbovschi SD, Hayat I та ін.
Багатоомні інтегровані мережі з’єднують метилювання ДНК і мікроРНК
пластичності скелетних м’язів до хронічних фізичних вправ при цукровому ожирінні 2 типу.
Фізіологічна геноміка. 2014;46:747�65.
84. Горват С, Ерхарт В, Брош М, Аммерполь О, фон Шенфельс В, Аренс М,
та ін. Ожиріння прискорює епігенетичне старіння печінки людини. Proc Natl Acad
наук. 2014;111:15538�43.
85. Альмін М.С., Нільссон Є.К., Якобссон Я.А., Калніна І., Кловінс Дж., Фредрікссон Р. та ін.
Аналіз у всьому геномі виявляє маркери метилювання ДНК, які змінюються залежно від
як вік, так і ожиріння. ген. 2014.;548:61�7
86. Хаусман Є.А., Молітор Дж., Марсіт С.Д. Коригування суміші клітин без посилання
в аналізі даних метилювання ДНК. Біоінформатика. 2014;30:1431�9.
87. Wells JC. Критична оцінка гіпотези прогностичної адаптивної реакції.
Int J Epidemiol. 2012;41:229.
88. Вільямс-Вісс О, Чжан С, Маклафлін С.М., Кліманн Д., Вокер С.К., Сутер
CM та ін. Кількість ембріонів і периконцепційне недоїдання в
вівці мають різний вплив на епігенотип надниркових залоз, ріст і
розвиток. Am J Physiol Endocrinol Metab. 2014;307:E141�50.
89. Zhang S, Rattanatray L, Morrison JL, Nicholas LM, Lie S, McMillen IC.
Ожиріння матері та ранні витоки дитячого ожиріння: зважування
переваги та витрати материнської втрати ваги в період периконцепції
період для потомства. Exp Diabetes Res. 2011;2011:585749.
90. Чжан С., Вільямс-Вісс О., Маклафлін С.М., Уокер С.К., Кліманн Д.О., Сутер
CM та ін. Недоїдання матері протягом першого тижня після зачаття
призводить до зниження експресії мРНК глюкокортикоїдних рецепторів
відсутність гіперметилювання GR екзону 17 у гіпофізі плода на пізніх термінах
вагітність. J Dev Orig Heal Dis. 2013;4:391�401.
91. Лі С., Моррісон Дж.Л., Вільямс-Вісс О., Сатер К.М., Хамфріс Д.Т., Озанн С.Е.,
та ін. Програми периконцепційного недоїдання змінюють сигнали інсуліну
молекули та мікроРНК у скелетних м’язах у одноплодних та близнюкових плодів
вівці. Biol Reprod. 2014;90:5.
92. Ван Стратен Е.М., ван Мер Х., Хейкман NC, ван Дейк Т.Х., Баллер Дж.Ф., Веркаде
HJ та ін. Активація Х-рецепторів печінки плода гостро індукує ліпогенез, але
не впливає на реакцію ліпідів плазми на дієту з високим вмістом жирів у дорослих мишей. Ам Дж
Physiol Endocrinol Metab. 2009;297:E1171�8.
93. Фернандес-Твінн DS, Alfaradhi MZ, Martin-Gronert MS, Duque-Guimaraes
DE, Piekarz A, Ferland-McCollough D та ін. Зниження IRS-1 в
Жирова тканина потомства мишей з ожирінням програмується клітинно-автономно
через посттранскрипційні механізми. Mol Metab.
2014;3:325.
94. Waterland RA, Travisano M, Tahiliani KG. Гіперметилювання, викликане дієтою при
життєздатний жовтий агути не успадковується через покоління через самку.
FASEB J. 2007;21:3380�5.
95. Ge ZJ, Luo SM, Lin F, Liang QX, Huang L, Wei YC та ін. Метилювання ДНК в
ооцити та печінка самок мишей та їх потомства: вплив дієти з високим вмістом жирів
ожиріння. Env Heal Perspect. 2014;122:159�64.
96. Ollikainen M, Ismail K, Gervin K, Kyll�nen A, Hakkarainen A, Lundbom J та ін.
Зміни метилювання ДНК крові на рівні регуляторних елементів у всьому геномі
і гетерохроматичні області у монозиготних близнюків, що не відповідають ожирінню
і печінковий жир. Клін Епігенетика. 2015;7:1�13.




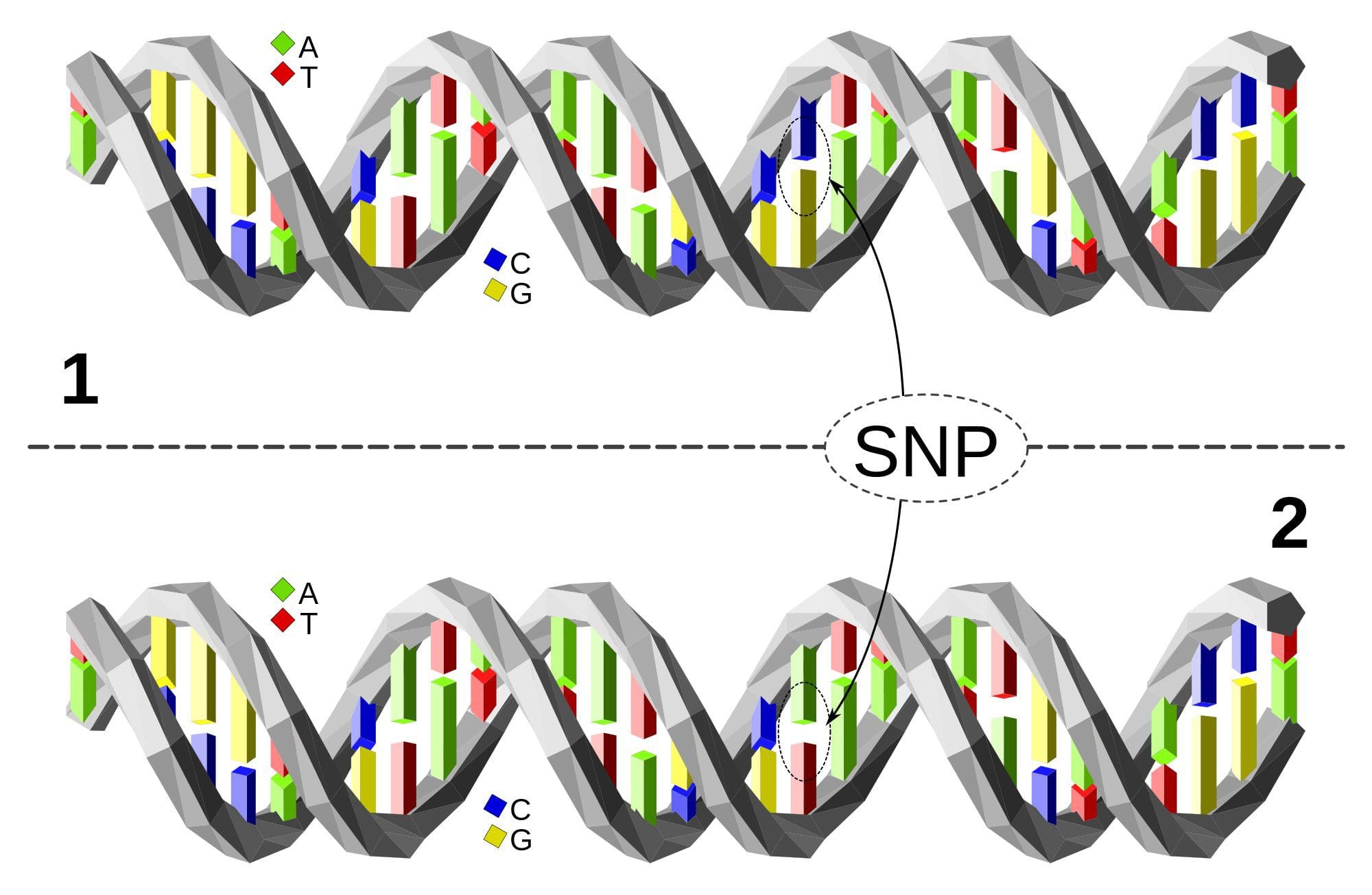
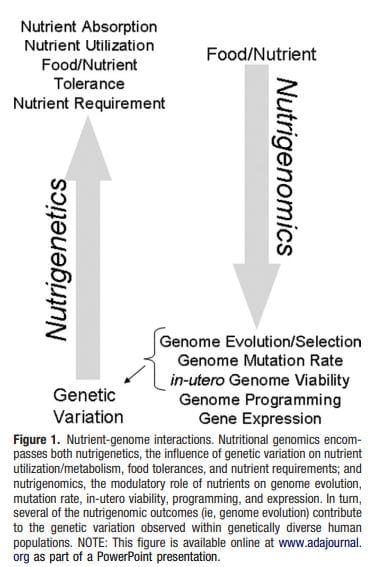




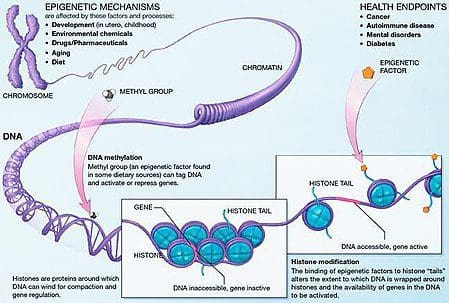 Ожиріння є складним багатофакторним захворюванням, і краще розуміння механізмів, що лежать в основі взаємодії між способом життя, навколишнім середовищем і генетикою, є критичним для розробки ефективних стратегій профілактики та лікування [1].
Ожиріння є складним багатофакторним захворюванням, і краще розуміння механізмів, що лежать в основі взаємодії між способом життя, навколишнім середовищем і генетикою, є критичним для розробки ефективних стратегій профілактики та лікування [1]. Моделі на тваринах надають унікальні можливості для суворо контрольованих досліджень, які дають механістичне уявлення про роль специфічних епігенетичних ознак, як індикаторів поточного метаболічного статусу, так і як провісників майбутнього ризику ожиріння та метаболічних захворювань. Особливо важливим аспектом досліджень на тваринах є те, що вони дозволяють оцінити епігенетичні зміни в тканинах-мішенях, включаючи печінку та гіпоталамус, що набагато складніше для людей. Крім того, здатність збирати велику кількість свіжої тканини дає змогу оцінити численні хроматинові позначки, а також метилювання ДНК. Деякі з цих епігенетичних модифікацій як окремо, так і в комбінації можуть реагувати на програмування навколишнього середовища. На тваринних моделях також можна вивчати кілька поколінь потомства і таким чином уможливити диференціацію між передачею ризику ожиріння між поколіннями та поколіннями, опосередкованого епігенетичною пам’яттю про харчовий статус батьків, який не можна легко відрізнити в дослідженнях на людях. Ми використовуємо перший термін для мейотичної передачі ризику за відсутності тривалого впливу, тоді як другий в першу чергу передбачає пряму передачу ризику через метаболічне перепрограмування плода або гамет.
Моделі на тваринах надають унікальні можливості для суворо контрольованих досліджень, які дають механістичне уявлення про роль специфічних епігенетичних ознак, як індикаторів поточного метаболічного статусу, так і як провісників майбутнього ризику ожиріння та метаболічних захворювань. Особливо важливим аспектом досліджень на тваринах є те, що вони дозволяють оцінити епігенетичні зміни в тканинах-мішенях, включаючи печінку та гіпоталамус, що набагато складніше для людей. Крім того, здатність збирати велику кількість свіжої тканини дає змогу оцінити численні хроматинові позначки, а також метилювання ДНК. Деякі з цих епігенетичних модифікацій як окремо, так і в комбінації можуть реагувати на програмування навколишнього середовища. На тваринних моделях також можна вивчати кілька поколінь потомства і таким чином уможливити диференціацію між передачею ризику ожиріння між поколіннями та поколіннями, опосередкованого епігенетичною пам’яттю про харчовий статус батьків, який не можна легко відрізнити в дослідженнях на людях. Ми використовуємо перший термін для мейотичної передачі ризику за відсутності тривалого впливу, тоді як другий в першу чергу передбачає пряму передачу ризику через метаболічне перепрограмування плода або гамет.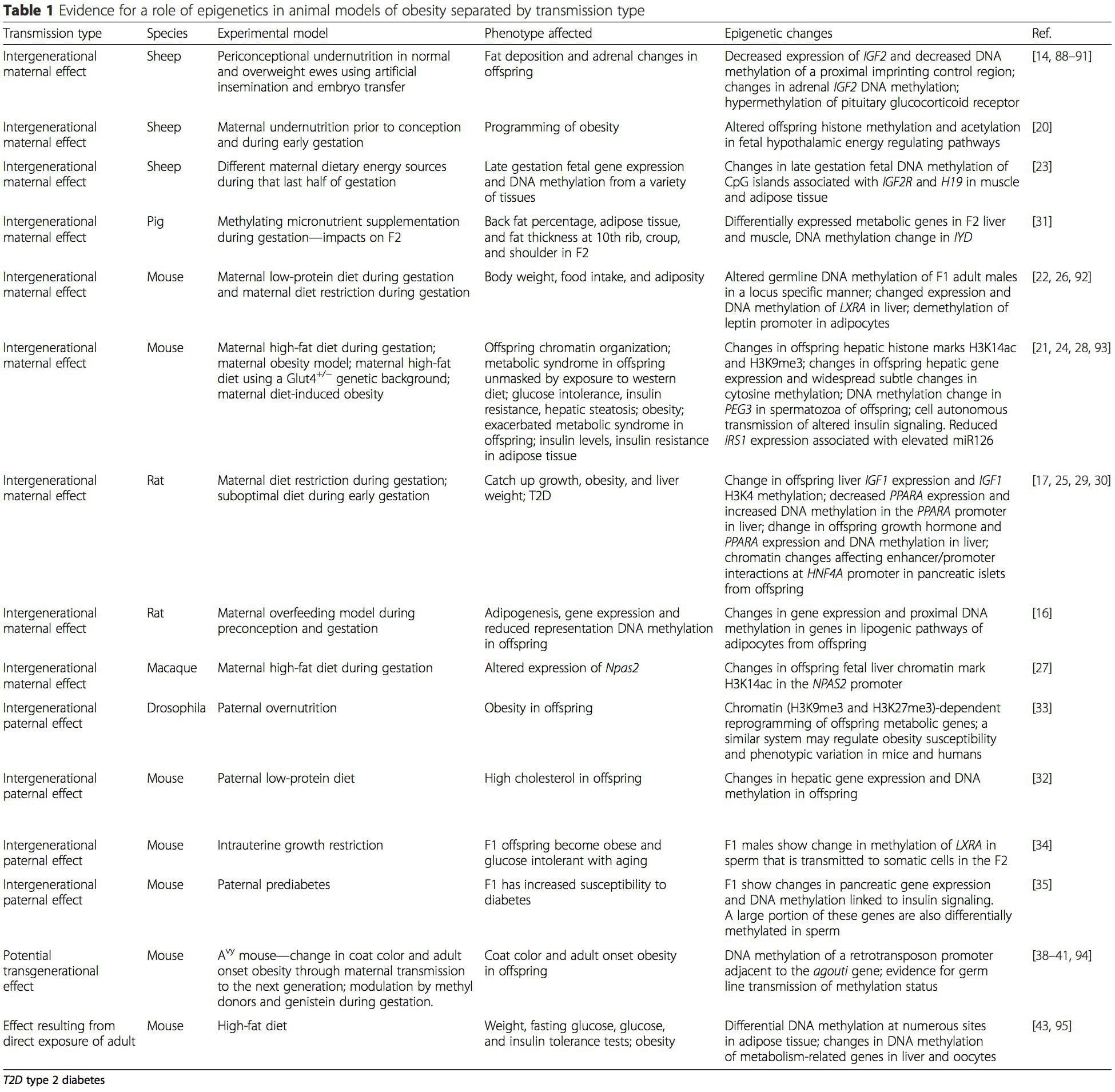 (i) Епігенетичні зміни у потомства, пов’язані з харчуванням матері під час вагітності
(i) Епігенетичні зміни у потомства, пов’язані з харчуванням матері під час вагітності Харчові добавки матері, недоїдання та надмірне харчування під час вагітності можуть змінити відкладення жиру та енергетичний гомеостаз у потомства [11, 13, 15, 19]. З цими ефектами у потомства пов’язані зміни метилювання ДНК, посттрансляційні модифікації гістонів та експресія генів кількох цільових генів, особливо генів, що регулюють метаболізм жирних кислот та передачу сигналів інсуліну [16, 17, 20–30]. Різноманітність тваринних моделей, використаних у цих дослідженнях, та загальні метаболічні шляхи, на які впливають, свідчать про еволюційно збережену адаптивну відповідь, опосередковану епігенетичною модифікацією. Однак деякі з конкретних ідентифікованих генів і епігенетичних змін були перехресно перевірені в пов’язаних дослідженнях, і широкомасштабні дослідження в масштабі всього геному, як правило, не застосовувалися. Основною перешкодою для порівняння цих досліджень є різні вікна розвитку психіки, які піддаються харчовим викликам, що може спричинити значно різні результати. Необхідно також довести, що епігенетичні зміни є причинними, а не пов’язаними з фенотиповими змінами потомства. Це вимагатиме виявлення батьківської реакції епігенетичної «пам’яті», викликаної харчуванням, яка передує розвитку зміненого фенотипу у потомства.
Харчові добавки матері, недоїдання та надмірне харчування під час вагітності можуть змінити відкладення жиру та енергетичний гомеостаз у потомства [11, 13, 15, 19]. З цими ефектами у потомства пов’язані зміни метилювання ДНК, посттрансляційні модифікації гістонів та експресія генів кількох цільових генів, особливо генів, що регулюють метаболізм жирних кислот та передачу сигналів інсуліну [16, 17, 20–30]. Різноманітність тваринних моделей, використаних у цих дослідженнях, та загальні метаболічні шляхи, на які впливають, свідчать про еволюційно збережену адаптивну відповідь, опосередковану епігенетичною модифікацією. Однак деякі з конкретних ідентифікованих генів і епігенетичних змін були перехресно перевірені в пов’язаних дослідженнях, і широкомасштабні дослідження в масштабі всього геному, як правило, не застосовувалися. Основною перешкодою для порівняння цих досліджень є різні вікна розвитку психіки, які піддаються харчовим викликам, що може спричинити значно різні результати. Необхідно також довести, що епігенетичні зміни є причинними, а не пов’язаними з фенотиповими змінами потомства. Це вимагатиме виявлення батьківської реакції епігенетичної «пам’яті», викликаної харчуванням, яка передує розвитку зміненого фенотипу у потомства. Нові дослідження продемонстрували, що батьківська площина харчування може впливати на відкладення жиру та епігенетичні ознаки потомства [31–34]. Одне нещодавнє дослідження з використанням мишей продемонструвало, що переддіабет у батька призводить до підвищеної сприйнятливості до діабету у нащадків F1 із пов’язаними змінами експресії генів підшлункової залози та метилюванням ДНК, пов’язаними з передачею сигналів інсуліну [35]. Важливо, що ці епігенетичні зміни в острівцях підшлункової залози та спермі збігаються, що свідчить про успадкування зародкової лінії. Однак більшість цих досліджень, хоча і інтригують за своїми наслідками, обмежені в масштабі геномного дослідження і часто показують слабкі та дещо тимчасові епігенетичні зміни, пов’язані з помірними метаболічними фенотипами у потомства.
Нові дослідження продемонстрували, що батьківська площина харчування може впливати на відкладення жиру та епігенетичні ознаки потомства [31–34]. Одне нещодавнє дослідження з використанням мишей продемонструвало, що переддіабет у батька призводить до підвищеної сприйнятливості до діабету у нащадків F1 із пов’язаними змінами експресії генів підшлункової залози та метилюванням ДНК, пов’язаними з передачею сигналів інсуліну [35]. Важливо, що ці епігенетичні зміни в острівцях підшлункової залози та спермі збігаються, що свідчить про успадкування зародкової лінії. Однак більшість цих досліджень, хоча і інтригують за своїми наслідками, обмежені в масштабі геномного дослідження і часто показують слабкі та дещо тимчасові епігенетичні зміни, пов’язані з помірними метаболічними фенотипами у потомства.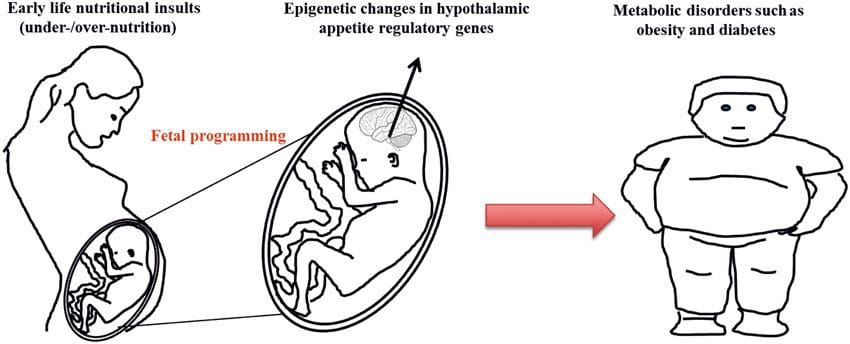 Стабільна передача епігенетичної інформації через кілька поколінь добре описана в рослинних системах і C. елегани, але його значення для ссавців досі є предметом дискусій [36, 37]. Епігенетична основа передачі фенотипів від бабусь і батьків у відповідь на дієтичне опромінення була добре встановлена, в тому числі у видів худоби [31]. У найвпливовіших дослідженнях, що демонструють вплив епігенетичної передачі, що впливає на фенотип потомства, використовувався приклад життєздатної жовтої миші агуті (Avy) [38]. У цієї миші вставка ретротранспозона перед геном агуті викликає його конститутивну експресію і, як наслідок, жовтий колір шерсті та ожиріння дорослих. Передача від матері через зародкову лінію призводить до опосередкованого метилюванням ДНК приглушення експресії агуті, що призводить до забарвлення шерсті дикого типу та худорлявого фенотипу потомства [39, 40]. Важливо, що наступні дослідження на цих мишах продемонстрували, що вплив матері донорів метилу викликає зміну кольору шерсті [41]. В одному дослідженні повідомлялося про передачу фенотипу до покоління F3 і зміни в експресії великої кількості генів у відповідь на обмеження білка в F0 [42]; проте, зміни в експресії були дуже варіабельними, і прямий зв'язок з епігенетичними змінами в цій системі не був виявлений.
Стабільна передача епігенетичної інформації через кілька поколінь добре описана в рослинних системах і C. елегани, але його значення для ссавців досі є предметом дискусій [36, 37]. Епігенетична основа передачі фенотипів від бабусь і батьків у відповідь на дієтичне опромінення була добре встановлена, в тому числі у видів худоби [31]. У найвпливовіших дослідженнях, що демонструють вплив епігенетичної передачі, що впливає на фенотип потомства, використовувався приклад життєздатної жовтої миші агуті (Avy) [38]. У цієї миші вставка ретротранспозона перед геном агуті викликає його конститутивну експресію і, як наслідок, жовтий колір шерсті та ожиріння дорослих. Передача від матері через зародкову лінію призводить до опосередкованого метилюванням ДНК приглушення експресії агуті, що призводить до забарвлення шерсті дикого типу та худорлявого фенотипу потомства [39, 40]. Важливо, що наступні дослідження на цих мишах продемонстрували, що вплив матері донорів метилу викликає зміну кольору шерсті [41]. В одному дослідженні повідомлялося про передачу фенотипу до покоління F3 і зміни в експресії великої кількості генів у відповідь на обмеження білка в F0 [42]; проте, зміни в експресії були дуже варіабельними, і прямий зв'язок з епігенетичними змінами в цій системі не був виявлений.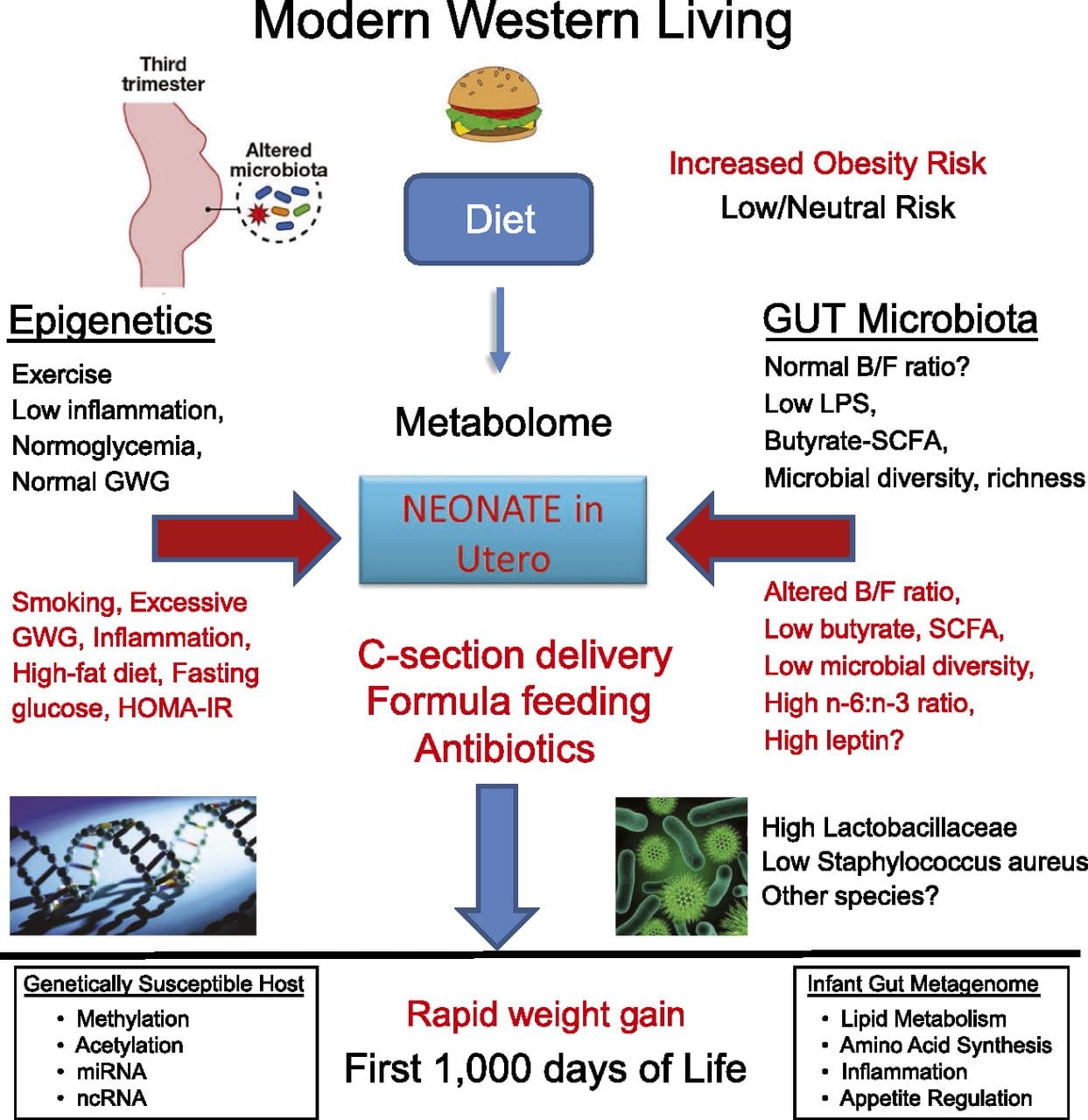 Незважаючи на те, що багато досліджень виявили епігенетичні зміни, пов’язані з дієтою, у тваринних моделях з використанням регіонів-кандидатів, специфічних для сайту, було проведено кілька аналізів у всьому геномі. Недавнє дослідження було зосереджено на визначенні прямого епігенетичного впливу дієт з високим вмістом жирів/ожиріння, викликаного дієтою, у дорослих мишей за допомогою геномної експресії генів і аналізу метилювання ДНК [43]. У цьому дослідженні було виявлено 232 диференційовано метиловані області (DMR) в адипоцитах контрольних мишей і мишей з високим вмістом жиру. Важливо, що відповідні людські області для мишачих DMR були також по-різному метиловані в жировій тканині від популяції людей з ожирінням і худих, тим самим підкреслюючи чудове еволюційне збереження цих регіонів. Цей результат підкреслює ймовірну важливість ідентифікованих DMR в регуляції енергетичного гомеостазу у ссавців.
Незважаючи на те, що багато досліджень виявили епігенетичні зміни, пов’язані з дієтою, у тваринних моделях з використанням регіонів-кандидатів, специфічних для сайту, було проведено кілька аналізів у всьому геномі. Недавнє дослідження було зосереджено на визначенні прямого епігенетичного впливу дієт з високим вмістом жирів/ожиріння, викликаного дієтою, у дорослих мишей за допомогою геномної експресії генів і аналізу метилювання ДНК [43]. У цьому дослідженні було виявлено 232 диференційовано метиловані області (DMR) в адипоцитах контрольних мишей і мишей з високим вмістом жиру. Важливо, що відповідні людські області для мишачих DMR були також по-різному метиловані в жировій тканині від популяції людей з ожирінням і худих, тим самим підкреслюючи чудове еволюційне збереження цих регіонів. Цей результат підкреслює ймовірну важливість ідентифікованих DMR в регуляції енергетичного гомеостазу у ссавців.
 (i) Дослідження генетичних асоціацій. Генетичні поліморфізми, які пов'язані з підвищеним ризиком розвитку певних станів, апріорі пов'язані з причинними генами. Наявність диференціального метилювання в таких областях робить висновок про функціональне значення цих епігенетичних змін у контролі експресії проксимального(их) гена(ів). Існують сильні генетичні ефекти, що діють на основі цис, що лежать в основі багатьох епігенетичних варіацій [7, 45], і в популяційних дослідженнях застосовувалися методи, які використовують генетичні сурогати для висновку про причинну або опосередковую роль відмінностей епігеномів [7, 46–48]. . Використання сімейної генетичної інформації також може призвести до ідентифікації потенційно причинних регіонів-кандидатів, що демонструють диференціальне метилювання, пов’язане з фенотипом [49].
(i) Дослідження генетичних асоціацій. Генетичні поліморфізми, які пов'язані з підвищеним ризиком розвитку певних станів, апріорі пов'язані з причинними генами. Наявність диференціального метилювання в таких областях робить висновок про функціональне значення цих епігенетичних змін у контролі експресії проксимального(их) гена(ів). Існують сильні генетичні ефекти, що діють на основі цис, що лежать в основі багатьох епігенетичних варіацій [7, 45], і в популяційних дослідженнях застосовувалися методи, які використовують генетичні сурогати для висновку про причинну або опосередковую роль відмінностей епігеномів [7, 46–48]. . Використання сімейної генетичної інформації також може призвести до ідентифікації потенційно причинних регіонів-кандидатів, що демонструють диференціальне метилювання, пов’язане з фенотипом [49].
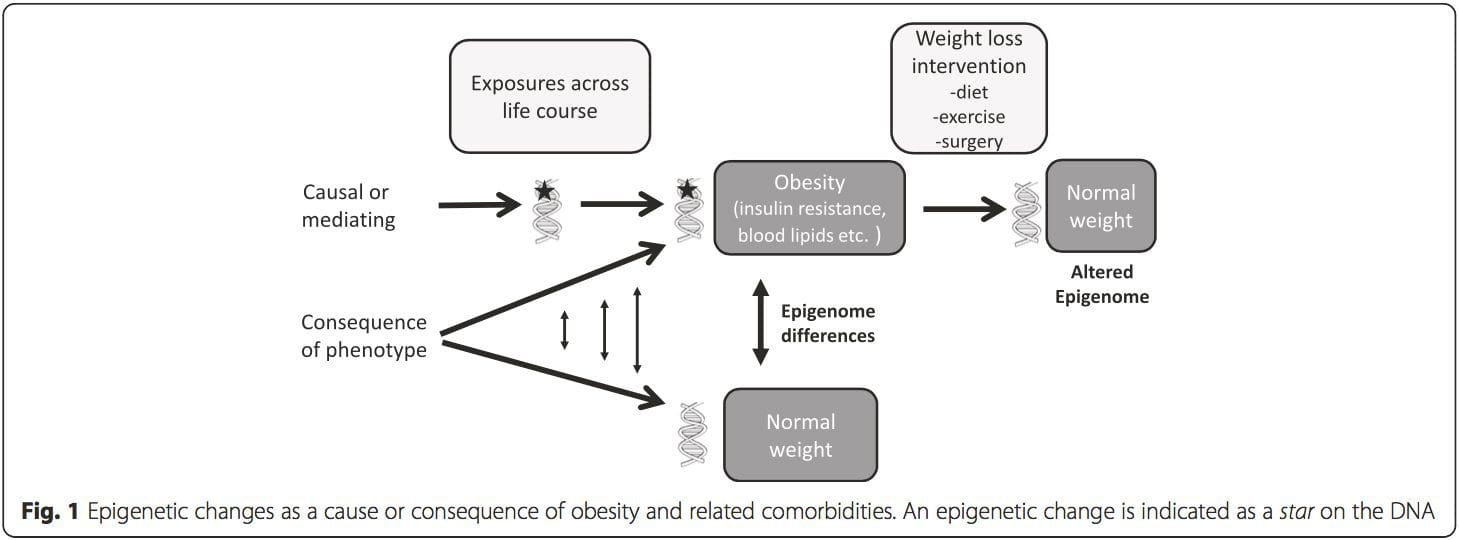
 З цих досліджень змінене метилювання PGC1A, HIF3A, ABCG1 і CPT1A і раніше описаний RXRA [18] з’явилися як біомаркери, пов’язані з метаболічним здоров’ям або, можливо, передбачають його, які також є вірогідними кандидатами на роль у розвитку метаболічних захворювань. .
З цих досліджень змінене метилювання PGC1A, HIF3A, ABCG1 і CPT1A і раніше описаний RXRA [18] з’явилися як біомаркери, пов’язані з метаболічним здоров’ям або, можливо, передбачають його, які також є вірогідними кандидатами на роль у розвитку метаболічних захворювань. .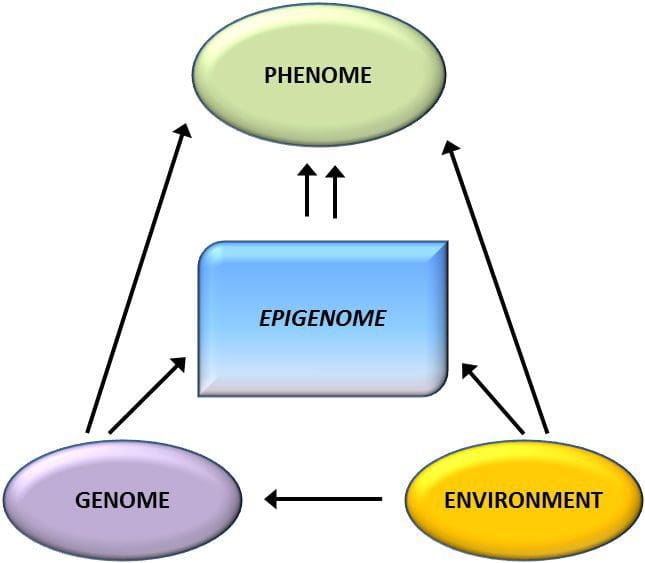 На епігенетичну мінливість сильно впливає генетична варіація, що лежить в основі, причому генотип, за оцінками, пояснює ~20 % варіації [40, 6]. Останнім часом розпочато ряд досліджень, які об’єднують дані про метилом і генотип, щоб ідентифікувати локуси кількісних ознак метилювання (meQTL), пов’язані з фенотипами захворювання. Наприклад, у жировій тканині meQTL, що перекривається з локусом генетичного ризику ІМТ, був ідентифікований в елементі-енхансері вище ADCY8 [3]. Інші дослідження також виявили збіги між відомими локусами ризику ожиріння та ЦД8 та DMR, пов’язаними з ожирінням та ЦД2 [2, 43, 48]. Метилювання ряду таких DMR також модулювалося шляхом харчування мишей з високим вмістом жиру [62] та втрати ваги у людей [43]. Ці результати виявляють інтригуючий зв’язок між генетичними варіаціями, пов’язаними зі сприйнятливістю до захворювань, та їх зв’язком з ділянками геному, які зазнають епігенетичних модифікацій у відповідь на проблеми з харчуванням, що передбачає причинно-наслідковий зв’язок. Тісний зв’язок між генетичною та епігенетичною варіаціями може означати їх істотну роль у створенні індивідуальних варіацій [64, 65]. Однак, хоча ці висновки свідчать про те, що метилювання ДНК може бути медіатором генетичних ефектів, важливо також враховувати, що як генетичні, так і епігенетичні процеси можуть діяти незалежно на ті самі гени. Дослідження близнюків [66, 8, 63] можуть дати важливу інформацію та вказати, що міжіндивідуальні відмінності в рівнях метилювання ДНК виникають переважно через неспільне середовище та стохастичні впливи, мінімально через спільні впливи навколишнього середовища, але також із значним впливом генетичних факторів. варіація.
На епігенетичну мінливість сильно впливає генетична варіація, що лежить в основі, причому генотип, за оцінками, пояснює ~20 % варіації [40, 6]. Останнім часом розпочато ряд досліджень, які об’єднують дані про метилом і генотип, щоб ідентифікувати локуси кількісних ознак метилювання (meQTL), пов’язані з фенотипами захворювання. Наприклад, у жировій тканині meQTL, що перекривається з локусом генетичного ризику ІМТ, був ідентифікований в елементі-енхансері вище ADCY8 [3]. Інші дослідження також виявили збіги між відомими локусами ризику ожиріння та ЦД8 та DMR, пов’язаними з ожирінням та ЦД2 [2, 43, 48]. Метилювання ряду таких DMR також модулювалося шляхом харчування мишей з високим вмістом жиру [62] та втрати ваги у людей [43]. Ці результати виявляють інтригуючий зв’язок між генетичними варіаціями, пов’язаними зі сприйнятливістю до захворювань, та їх зв’язком з ділянками геному, які зазнають епігенетичних модифікацій у відповідь на проблеми з харчуванням, що передбачає причинно-наслідковий зв’язок. Тісний зв’язок між генетичною та епігенетичною варіаціями може означати їх істотну роль у створенні індивідуальних варіацій [64, 65]. Однак, хоча ці висновки свідчать про те, що метилювання ДНК може бути медіатором генетичних ефектів, важливо також враховувати, що як генетичні, так і епігенетичні процеси можуть діяти незалежно на ті самі гени. Дослідження близнюків [66, 8, 63] можуть дати важливу інформацію та вказати, що міжіндивідуальні відмінності в рівнях метилювання ДНК виникають переважно через неспільне середовище та стохастичні впливи, мінімально через спільні впливи навколишнього середовища, але також із значним впливом генетичних факторів. варіація. Пренатальне середовище: Два нещодавно опубліковані дослідження використовували людські популяції, у яких спостерігалися «природні» зміни в забезпеченні поживними речовинами для вивчення впливу харчування матері до або під час вагітності на метилювання ДНК у потомства [68, 69]. У першому дослідженні використовувалася гамбійська когорта матері-дитини, щоб показати, що як сезонні зміни в споживанні матір’ю метилу донора під час вагітності, так і ІМТ матері до вагітності були пов’язані зі зміненим метилюванням у немовлят [69]. У другому дослідженні використовували доросле потомство з когорти Dutch Hunger Winter для дослідження впливу пренатального впливу гострого періоду серйозного недоїдання матері на метилювання ДНК генів, які беруть участь у зростанні та метаболізмі в дорослому віці [68]. Результати підкреслили важливість часу опромінення для його впливу на епігеном, оскільки значні епігенетичні ефекти були виявлені лише у осіб, які постраждали від голоду на ранніх термінах вагітності. Важливо, що епігенетичні зміни відбувалися в поєднанні зі збільшенням ІМТ; однак у цьому дослідженні не вдалося встановити, чи були ці зміни раніше в житті, чи були наслідком більш високого ІМТ.
Пренатальне середовище: Два нещодавно опубліковані дослідження використовували людські популяції, у яких спостерігалися «природні» зміни в забезпеченні поживними речовинами для вивчення впливу харчування матері до або під час вагітності на метилювання ДНК у потомства [68, 69]. У першому дослідженні використовувалася гамбійська когорта матері-дитини, щоб показати, що як сезонні зміни в споживанні матір’ю метилу донора під час вагітності, так і ІМТ матері до вагітності були пов’язані зі зміненим метилюванням у немовлят [69]. У другому дослідженні використовували доросле потомство з когорти Dutch Hunger Winter для дослідження впливу пренатального впливу гострого періоду серйозного недоїдання матері на метилювання ДНК генів, які беруть участь у зростанні та метаболізмі в дорослому віці [68]. Результати підкреслили важливість часу опромінення для його впливу на епігеном, оскільки значні епігенетичні ефекти були виявлені лише у осіб, які постраждали від голоду на ранніх термінах вагітності. Важливо, що епігенетичні зміни відбувалися в поєднанні зі збільшенням ІМТ; однак у цьому дослідженні не вдалося встановити, чи були ці зміни раніше в житті, чи були наслідком більш високого ІМТ. Післяпологове середовище: Епігеном встановлюється de novo під час ембріонального розвитку, і тому пренатальне середовище, швидше за все, має найбільш значний вплив на епігеном. Однак тепер зрозуміло, що зміни відбуваються в «зрілому» епігеномі під впливом ряду умов, включаючи старіння, вплив токсинів та зміни в дієті. Наприклад, у відповідь на дієту з високим вмістом жирів було продемонстровано зміни метилювання ДНК у численних генах скелетних м’язів і PGC1A в жировій тканині [75, 76]. Втручання, спрямовані на втрату жирової маси тіла, також були пов’язані зі змінами метилювання ДНК. Дослідження показали, що профілі метилювання ДНК жирової тканини [43, 64], мононуклеарних клітин периферичної крові [77] та м’язової тканини [78] у пацієнтів, які раніше страждали ожирінням, стають більш схожими на профілі худих суб’єктів після втрати ваги. Операція щодо зниження ваги також частково звернула на протилежні зміни метилювання, пов’язані з неалкогольною жировою хворобою печінки, в печінці [79], а в іншому дослідженні призвела до гіпометилювання множинних генів-кандидатів на ожиріння з більш вираженими ефектами в підшкірній клітковині порівняно з сальниковим (вісцеральним) жиром [64]. . Накопичені дані свідчать про те, що фізичні вправи також можуть впливати на метилювання ДНК. Більшість із цих досліджень було проведено на худорлявих осіб [80–82], але одне дослідження фізичних вправ у пацієнтів із ЦД 2-го типу з ожирінням також продемонструвало зміни в метилуванні ДНК, у тому числі в генах, що беруть участь у транспорті жирних кислот і глюкози [83]. Епігенетичні зміни також відбуваються зі старінням, і останні дані свідчать про роль ожиріння в їх посиленні [9, 84, 85]. Ожиріння прискорювало епігенетичний вік тканини печінки, але на відміну від результатів, описаних вище, цей ефект не був оборотним після втрати ваги [84].
Післяпологове середовище: Епігеном встановлюється de novo під час ембріонального розвитку, і тому пренатальне середовище, швидше за все, має найбільш значний вплив на епігеном. Однак тепер зрозуміло, що зміни відбуваються в «зрілому» епігеномі під впливом ряду умов, включаючи старіння, вплив токсинів та зміни в дієті. Наприклад, у відповідь на дієту з високим вмістом жирів було продемонстровано зміни метилювання ДНК у численних генах скелетних м’язів і PGC1A в жировій тканині [75, 76]. Втручання, спрямовані на втрату жирової маси тіла, також були пов’язані зі змінами метилювання ДНК. Дослідження показали, що профілі метилювання ДНК жирової тканини [43, 64], мононуклеарних клітин периферичної крові [77] та м’язової тканини [78] у пацієнтів, які раніше страждали ожирінням, стають більш схожими на профілі худих суб’єктів після втрати ваги. Операція щодо зниження ваги також частково звернула на протилежні зміни метилювання, пов’язані з неалкогольною жировою хворобою печінки, в печінці [79], а в іншому дослідженні призвела до гіпометилювання множинних генів-кандидатів на ожиріння з більш вираженими ефектами в підшкірній клітковині порівняно з сальниковим (вісцеральним) жиром [64]. . Накопичені дані свідчать про те, що фізичні вправи також можуть впливати на метилювання ДНК. Більшість із цих досліджень було проведено на худорлявих осіб [80–82], але одне дослідження фізичних вправ у пацієнтів із ЦД 2-го типу з ожирінням також продемонструвало зміни в метилуванні ДНК, у тому числі в генах, що беруть участь у транспорті жирних кислот і глюкози [83]. Епігенетичні зміни також відбуваються зі старінням, і останні дані свідчать про роль ожиріння в їх посиленні [9, 84, 85]. Ожиріння прискорювало епігенетичний вік тканини печінки, але на відміну від результатів, описаних вище, цей ефект не був оборотним після втрати ваги [84].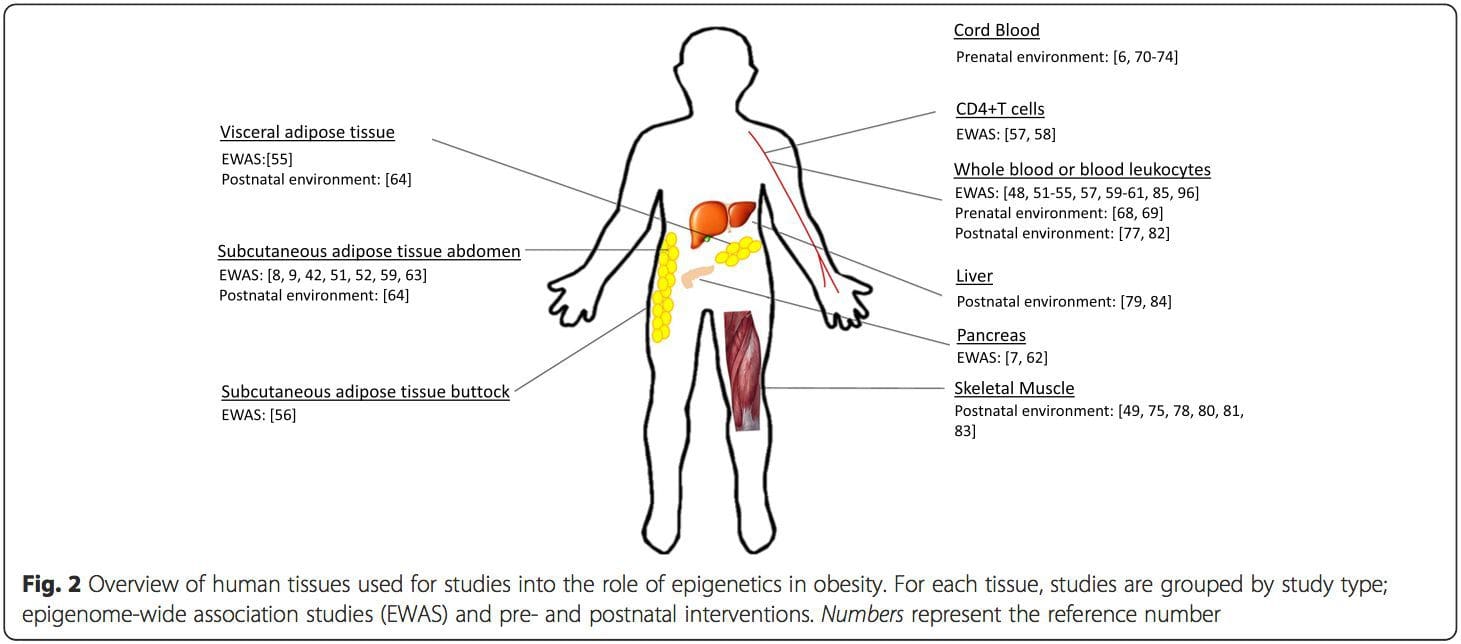 Висновки
Висновки



