Нейрозапалення:
абстрактний
Численні докази підтверджують патогенну роль нейрозапалення в психіатричних захворюваннях. У той час як системні аутоімунні захворювання є добре задокументованими причинами нервово-психічних розладів, синаптичні аутоімунні енцефаліти з психотичними симптомами часто не визнаються. Паралельно зі зв’язком між психіатричними симптомами та аутоімунітетом при аутоімунних захворюваннях, нейроімунологічні відхилення виникають при класичних психічних розладах (наприклад, велика депресія, біполярний розлад, шизофренія та обсесивно-компульсивні розлади). Дослідження патофізіології цих станів традиційно підкреслювали порушення регуляції глутаматергічної та моноамінергічної систем, але механізми, що викликають ці порушення нейромедіаторів, залишалися невловимими. Ми розглядаємо зв’язок між аутоімунітетом і нервово-психічними розладами, а також людські та експериментальні дані, що підтверджують патогенну роль нейрозапалення в окремих класичних психіатричних розладах. Розуміння того, як взаємодіють психосоціальні, генетичні, імунологічні та нейромедіаторні системи, може виявити патогенні підказки та допомогти налаштувати нові профілактичні та симптоматичні методи лікування.
Ключові слова:
- нейрозапалення,
- Психонейроімунологія,
- астроцит,
- мікроглія,
- цитокіни,
- Окислювальний стрес,
- Депресія
- Обсесивно-компульсивний розлад,
- Біполярний розлад, шизофренія
зміст
Вступ
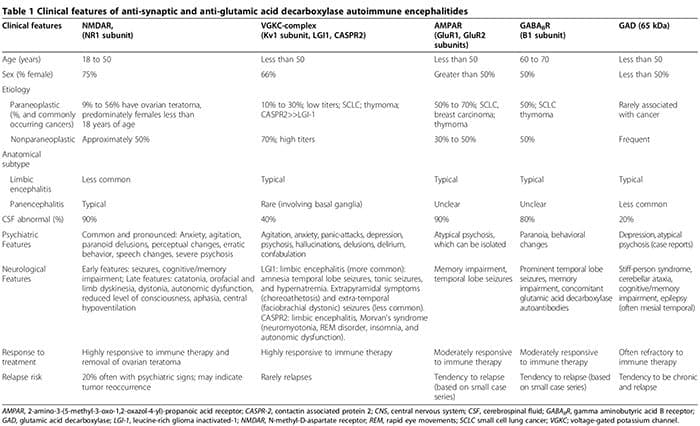
Оскільки біологічні відхилення все частіше виявляються серед пацієнтів із психічними розладами, відмінність між неврологічними та психічними захворюваннями зникає. Крім системних аутоімунних захворювань, пов’язаних із психічними проявами (наприклад, вовчак) [1], останнім часом у пацієнтів з гострими ізольованими психозами виявляли синаптичні аутоімунні енцефаліти (табл. 1) [2-6]. У цих пацієнтів часто помилково діагностують рефрактерні первинні психотичні розлади, що відкладає початок ефективної імунної терапії (табл. 1). Крім того, все більше даних підтверджують патогенну роль антинейрональних антитіл у нервово-психічних розладах [7].
Розділ неврологічних і психіатричних розладів, підкріплений концепцією Декарта про «розум» як онтологічно відмінну сутність і відтворюваність нейропатологічних аномалій, домінував у медицині в.19 на початку 20 століть [8]. Відтоді зростаюча колекція відтворюваних біологічних причин, починаючи з нейросифілісу, травми голови, інсульту, пухлини, демієлінізації та багатьох інших, викликала комплекси симптомів, які перетиналися з класичними психічними розладами [9-11]. Зовсім недавно у пацієнтів із класичними психічними розладами були задокументовані нейрозапальні та імунологічні відхилення.
Периферичні імуномодулятори можуть викликати психіатричні симптоми у моделей тварин і людей [12-19]. Здоровим тваринам вводять прозапальний IL-1? і цитокіни фактора некрозу пухлин альфа (TNF-?) демонструють «хворобну поведінку», пов'язану із соціальним відстороненням [12]. У людей ін’єкції низьких доз ендотоксину дезактивують вентральний смугастий мозок, область, критичну для обробки винагороди, викликаючи ангедонію як виснажливий депресивний симптом [14]. Приблизно 45% хворих на гепатит С і рак без депресії, які отримували ІФН-? розвиваються депресивні симптоми, пов’язані з підвищенням рівня IL-6 у сироватці крові [12,15,17,18].
Медичні стани, пов’язані з хронічними запальними та імунологічними відхиленнями, включаючи ожиріння, діабет, злоякісні новоутворення, ревматоїдний артрит і розсіяний склероз, є факторами ризику депресії та біполярного розладу [10,12,13,15,17,18]. Позитив�кореляція між цими медичними станами та психічними захворюваннями свідчить про наявність широкого основного запального процесу, що вражає мозок серед інших органів [10,19,20]. 30-річне популяційне дослідження показало, що наявність аутоімунне захворювання або попередня госпіталізація з приводу серйозної інфекції підвищувала ризик розвитку шизофренії на 29% і 60% відповідно [16]. Крім того, вірус простого герпесу, Toxoplasma gondii, цитомегаловірус та грип під час вагітності підвищують ризик розвитку шизофренії [16].
Периферичні клітинні [21,22, 2] (Таблиця 13,21) та гуморальні імунологічні аномалії [23, 34-43] є більш поширеними у психіатричних пацієнтів порівняно зі здоровими представниками контрольної групи. В обох пілотних (n = 36 пацієнти з великим депресивним розладом (MDD), n = 43 здорових контрольної групи) і реплікаційних дослідженнях (n = 91.7 MDD, n = 81.3 здорових контрольних), аналіз сироватки, що включає дев'ять сироваткових біомаркерів, відрізняв суб'єктів MDD від здорових. контролі з чутливістю 1% і специфічністю 23%; значно підвищеними біомаркерами нервово-психічних симптомів були імунологічні молекули альфа-XNUMX-антитрипсин, мієлопероксидаза та розчинний TNF-? рецептор II [XNUMX].
 Спочатку ми розглянемо зв’язок між аутоімунітетом та нервово-психічними розладами, включаючи: 1) системний червоний вовчак (СКВ) як прототип системного аутоімунного захворювання; 2) аутоімунні енцефаліти, асоційовані з сироватковими антисинаптичними аутоантитілами та декарбоксилазою глутамінової кислоти (GAD); і 3) дитячі нейропсихіатричні аутоімунні розлади, пов'язані зі стрептококовими інфекціями (PANDAS), і чистий обсесивно-компульсивний розлад (ОКР), пов'язаний з антибазальними гангліями/таламічними аутоантитілами. Потім ми обговорюємо роль вродженого запалення/аутоімунітету в класичних психічних розладах, включаючи MDD, біполярний розлад (BPD), шизофренію та OCD.
Спочатку ми розглянемо зв’язок між аутоімунітетом та нервово-психічними розладами, включаючи: 1) системний червоний вовчак (СКВ) як прототип системного аутоімунного захворювання; 2) аутоімунні енцефаліти, асоційовані з сироватковими антисинаптичними аутоантитілами та декарбоксилазою глутамінової кислоти (GAD); і 3) дитячі нейропсихіатричні аутоімунні розлади, пов'язані зі стрептококовими інфекціями (PANDAS), і чистий обсесивно-компульсивний розлад (ОКР), пов'язаний з антибазальними гангліями/таламічними аутоантитілами. Потім ми обговорюємо роль вродженого запалення/аутоімунітету в класичних психічних розладах, включаючи MDD, біполярний розлад (BPD), шизофренію та OCD.
Нервово-психічні розлади, пов’язані з аутоімунітетом
Системний червоний вовчак
Від 25% до 75% пацієнтів з ВКВ мають ураження центральної нервової системи (ЦНС), при цьому психіатричні симптоми зазвичай виникають протягом перших двох років від початку захворювання. Психічні симптоми можуть включати тривожність, настрій і психотичні розлади [97]. Магнітно-резонансна томографія головного мозку (МРТ) є нормальною приблизно у 42% нейропсихічних випадків СЧВ [97]. Мікроангіопатія та порушення гематоенцефалічного бар’єру (ГЕБ) можуть сприяти проникненню аутоантитіл у мозок [97]. Ці антитіла включають антирибосомальний Р (позитивний у 90% пацієнтів із психотичним ВКВ) [1], антиендотеліальні клітини, антиганглозиди, анти-dsDNA, анти-2A/2B субодиниці N-метил-D-аспартатних рецепторів ( NMDAR) та антифосфоліпідні антитіла [97]. Прозапальні цитокіни – в основному IL-6 [97], S100B�[97], молекула внутрішньоклітинної адгезії 1 [97] і матрикс-металопротеїназа-9 [98] також підвищені при СЧВ. Нещодавно були розглянуті психічні прояви СЧВ, хвороби Шегрена, синдрому Сюзака, васкуліту ЦНС, хвороби Уіппла та хвороби Бехчета [1].
Нейропсихіатричні аутоімунні енцефаліти, пов’язані з антисинаптичною декарбоксилазою сироватки та глутамінової кислоти
Автоантитіла
Аутоімунний енцефаліт характеризується гострим початком скроневих судом, психіатричними особливостями та когнітивними порушеннями [2,3,99-108]. Патофізіологія зазвичай опосередковується аутоантитілами, спрямованими на синаптичні або внутрішньоклітинні аутоантигени у зв’язку з паранеопластичним або непаранеопластичним походженням [3]. Антисинаптичні аутоантитіла націлені на субодиниці NR1 NMDAR [100,108,109], комплекси напругозалежних калієвих каналів (VGKC) (субодиниця Kv1, інактивована гліома, багата лейцином (LGI1) і асоційований з контактином білок 2 (CASPR2)) [101,102,106] [1] Субодиниці GluR2 рецептора аміно-3-гідрокси-5-метил-4-6,110,111-ізоксазолпропіонової кислоти (AMPAR) [1] та субодиниці B3,99,103 рецепторів ?-аміномасляної кислоти (GABABR) [65]. Антивнутрішньоклітинні аутоантитіла націлені на онконейрональні аутоантигени та аутоантигени GAD-2,3 [XNUMX].
Запалення, пов’язане з антисинаптичними аутоантитілами, зокрема NMDAR-аутоантитілами, зазвичай набагато м’якше, ніж запалення, пов’язане з аутоантитілами до GAD або антинейрональними аутоантитілами, пов’язаними із системними аутоімунними розладами або паранеопластичними синдромами [2,107].
Хоча неврологічні симптоми з часом з’являються, психіатричні прояви, починаючи від тривоги [2,3] до психозу, що імітує шизофренію [2-6], можуть спочатку домінувати або передувати неврологічним ознакам. До двох третин пацієнтів з анти-NMDAR аутоімунним енцефалітом спочатку звертаються до психіатричних служб [5]. Аутоімунні енцефаліти, опосередковані антисинаптичними антитілами, необхідно враховувати при диференціації гострого психозу [2-6]. Психіатричні прояви можуть включати звичайну МРТ головного мозку та аналіз спинномозкової рідини (СМР), без енцефалопатії та судом [2,3,5,6,107]. Ми повідомили про випадок серопозитивних аутоантитіл GAD, пов’язаних із нейрозапаленням, підтвердженим біопсією, незважаючи на звичайні аналізи МРТ головного мозку та спинномозкової рідини, коли у пацієнта був ізольований психоз, діагностований як шизофренія за критеріями Діагностичного та статистичного посібника з психічних розладів, 4-е видання (DSM-IV). [2]. Крім того, серонегативні аутоімунні енцефаліти можуть також мати виражені нервово-психічні розлади, що робить діагностику більш невловимою [107,112,113]. Психіатричні та неврологічні особливості, пов'язані з антисинаптичними та аутоантитілами до GAD, узагальнено в таблиці 1 [1-6,99-108,114].
У пацієнтів із чистими психічними розладами можуть виникати сироваткові антисинаптичні та аутоантитіла до GAD [2,4,5,112,115-121]. У проспективній когорті з 29 суб’єктів, які відповідали критеріям шизофренії DSM-IV, сироваткові анти-NMDAR аутоантитіла були виявлені в трьох суб’єктів, а анти-VGKC-комплекс аутоантитіла були виявлені в одного пацієнта [5]. Використовуючи більш чутливі методики виявлення аутоантитіл імуноглобуліну G (IgG) NR1 у 100 пацієнтів із певною шизофренією, аутоантитіла не виявлено [122]. Однак це дослідження не оцінювало аутоантитіла, спрямовані на субодиницю NR2 NMDAR. В інших дослідженнях повідомлялося про суттєво підвищені шанси підвищення ( 90-й процентиль непсихіатричних контрольних рівнів) рівнів антитіл NR2 (відношення шансів (OR) 2.78, 95% довірчий інтервал (ДІ) 1.26–6.14, P = 0.012) серед осіб з гострою манією ( n = 43), але не при хронічній манії чи шизофренії [116].
PANDAS і чистий обсесивно-компульсивний розлад, пов'язаний з антибазальними гангліями/таламічними аутоантитілами
ОКР часто ускладнює неврологічні розлади, що включають базальні ганглії, включаючи хорею Сіденхема, хворобу Гентінгтона та хворобу Паркінсона. Антитіла до базальних гангліїв причетні до хореї Сиденгама [123]. PANDAS характеризується гострим загостренням симптомів ОКР та/або моторними/фонічними тиками після продромальної ?-гемолітичної стрептококової інфекції групи А. Вважається, що патофізіологія включає перехресну реактивність між антистрептококовими антитілами та білками базальних гангліїв [124]. Клінічне збігання між PANDAS і чистим OCD свідчить про загальний етіологічний механізм [125].
Серед випадкової когорти з 21 пацієнта з чистим ОКР 91.3% мали антибазальні ганглії в спинномозковій рідині (P <0.05) і антиталамічні аутоантитіла (P <0.005) при 43 кДа [88], паралельно з функціональними аномаліями в кірково-стріатрально-таламо -кортикальна схема суб'єктів ОКР [84]. Інше дослідження задокументувало, що 42% (n = 21) пацієнтів з ОКР у дітей та підлітків мали сироваткові аутоантитіла до базальних гангліїв у 40, 45 і 60 кДа порівняно з 2% до 10% контрольної групи (P = 0.001) [7]. Аутоантитіла до базальних гангліїв були виявлені в сироватці 64% суб’єктів PANDAS (n = 14), порівняно з лише 9% (n = 2) у контролях, позитивних на стрептококи/ОКР (Р <0.001) [126]. В одному дослідженні не виявлено різниці між поширеністю аутоантитіл проти базальних гангліїв при ОКР (5.4%, n = 4) порівняно з контрольними групами MDD (0%) [127]; однак обмеженням було випадкове використання кори головного мозку щурів і базальних гангліїв і кори великої рогатої худоби, що могло обмежити виявлення серопозитивних випадків.
Аутоантигенами базальних гангліїв є альдолаза С (40 кДа), нейрон-специфічна/ненейрональна енолаза (дуплет 45 кДа) і піруваткіназа М1 (60 кДа) — нейронні гліколітичні ферменти, які беруть участь у передачі нейронів, нейронному метаболізмі.
Сторінка 3 з 24 і передача сигналів клітини [128]. Ці ферменти демонструють значну структурну гомологію зі стрептококовими білками [129]. В останньому дослідженні (96 OCD, 33 MDD, 17 суб'єктів шизофренії) було перевірено сироватку пацієнтів на піруваткіназу, альдолазу C та енолазу, зокрема; більша частка суб’єктів ОКР була серопозитивною порівняно з контролем (19.8% (n = 19) проти 4% [n = 2], P = 0.012) [130].
Проте в цьому ж дослідженні лише один із 19 серопозитивних суб’єктів OCD також мав позитивні титри антитіл до стрептолізину O, що свідчить про те, що в чистому OCD серонегативність антитіла до стрептолізину O не виключає наявності аутоантитіл проти базальних гангліїв. .
При чистому ОКР серопозитивність антитіл проти базальних гангліїв/таламічних антитіл пов’язана з підвищенням рівня гліцину в спинномозковій рідині (P = 0.03) [88], що свідчить про те, що ці антитіла сприяють гіперглутаматергії, що спостерігається при ОКР [84,88,131]. Поліпшення ОКР, спровокованого інфекцією, за допомогою імунної терапії підтримує патогенність цих аутоантитіл [132]. Триває велике дослідження NIH, яке оцінює ефективність внутрішньовенного імуноглобуліну (IVIG) для дітей з гострим початком ОКР та антистрептококових антитіл (ClinicalTrials.gov: NCT01281969). Однак виявлення дещо вищих рівнів глутамату в спинномозковій рідині у пацієнтів з ОКР з негативними антибазальними гангліями/таламічними антитілами в спинномозковій рідині в порівнянні з тими з позитивними антитілами до спинномозкової рідини свідчить про те, що неімунологічні механізми можуть відігравати роль у ОКР [84]. Інші механізми, включаючи цитокін-опосередковане запалення (Таблиця 2), також є гіпотезами.
Психічні розлади, пов’язані з вродженим запаленням
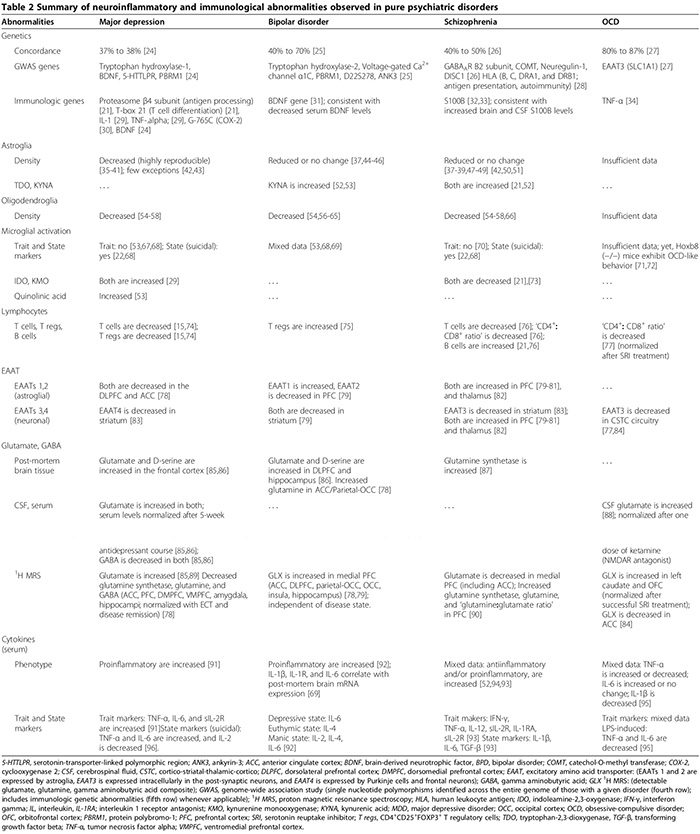
У деяких пацієнтів із класичними психічними розладами виникають розлади вродженого запалення/аутоімунітету. Ми обговорюємо вроджені аномалії ЦНС, пов’язані із запаленням, включаючи гліальну патологію, підвищені рівні цитокінів, активацію циклооксигенази, порушення регуляції глутамату, підвищення рівня S100B, підвищений окислювальний стрес та дисфункцію ГЕБ при БДР, БЛД, шизофренії та OCD. Ми також описуємо, як вроджене запалення може бути механічно пов’язане з традиційними моноамінергічними та глутаматергічними аномаліями, про які повідомлялося при цих розладах (рис. 1 і 2). Також розглянуто терапевтичну роль протизапальних засобів при психічних розладах.
 Астрогліальна та олігодендрогліальна гістопатологія
Астрогліальна та олігодендрогліальна гістопатологія
Астроглія і олігодендроглія необхідні для нервової системи метаболічний гомеостаз, поведінка та вищі когнітивні функції [54-56,133-136]. Нормальна спокою астроглія забезпечує енергетичну та трофічну підтримку нейронів, регулює синаптичну нейротрансмісію (Малюнок 2), синаптогенез, мозковий кровотік і підтримує цілісність ГЕБ [134,136,137]. Зрілі олігодендроглії забезпечують енергетичну та трофічну підтримку нейронів і підтримують цілісність ГЕБ, а також регулюють відновлення аксонів�та мієлінізація шляхів білої речовини, що забезпечує між- та внутрішньопівкульну зв'язок [54-56]. І астроглія, і олігодендроглія виробляють протизапальні цитокіни, які можуть пригнічувати шкідливе запалення [52,55].
При MDD втрата астроглії є постійним посмертним виявленням у функціонально відповідних областях, включаючи передню поясну кору, префронтальну кору, мигдалину та білу речовину [35-38,42-46,55,138-147], за деякими винятками [42,43 ,37,38]. Посмертні дослідження виявили знижену щільність астроглії, позитивну з фібрилярного кислого білка гліального фібрилярного білка (GFAP), переважно в префронтальній корі [36, 39] та мигдалині [75]. Великий протеомний аналіз лобової кори у пацієнтів з депресією показав значне зниження трьох ізоформ GFAP [45]. Хоча в одному дослідженні, яке не повідомляло про значну втрату глії, аналіз підгруп виявив значне зниження (35%) GFAP-позитивної астрогліальної щільності серед суб’єктів дослідження молодше 148 років [35]. Морфометричне дослідження подібним чином не показало жодних змін у щільності глії в мозку пізніх років з MDD [42,50]. Ми припускаємо, що очевидна відсутність втрати астроглії серед пацієнтів старшого віку з МДР може відображати вторинний астрогліоз [XNUMX], який асоціюється зі старшим віком [XNUMX], а не справжній негативний результат.
Дослідження на тваринах узгоджуються з дослідженнями на людях, які показують втрату астроглії при MDD. Щури Wistar-Kyoto, як відомо, демонструють депресивну поведінку, виявили знижену щільність астроглії в тих же областях, що і у людей [40]. Введення астрогліально-токсичного агента, L-альфа-аміноадипінової кислоти, викликає депресивні симптоми у щурів, що свідчить про те, що втрата астроглії є патогенною при БДР [41].
Посмертні дослідження суб’єктів з МДР задокументували знижену щільність олігодендроглії в префронтальній корі та мигдалині [54-57,66], що може корелювати зі змінами вогнищевої білої речовини головного мозку на МРТ головного мозку, які іноді відзначаються у деяких пацієнтів із МРД [57]. Однак мікросудинні аномалії також можуть сприяти цим змінам [57].
При БЛД деякі дослідження демонструють значну втрату гліальної тканини [138,143,149,150], а інші – ні [37,44-46]. Ці суперечливі висновки можуть бути наслідком відсутності контролю щодо: 1) лікування стабілізаторами настрою, оскільки пост-хос аналіз, про який повідомляють деякі дослідження, показав значне зниження втрати гліальної тканини лише після контролю лікування літієм та вальпроєвою кислотою [46]; 2) сімейні форми БЛД, оскільки втрата глії особливо помітна серед пацієнтів з БЛД із сильною сімейною історією [143]; та/або, 3) переважний стан депресії проти манії, оскільки втрата гліальної тканини часто зустрічається при МДР [35-38,42-46,55,138-147]. Неясно, чи астроглія чи олігодендроглія є причиною більшості втрат гліальних клітин; протеомічний аналіз виявив значне зниження однієї ізоформи астроглії GFAP [39], кілька інших посмертних досліджень виявили або незмінну [36,37], або знижену GFAP-позитивну астрогліальну експресію в орбітофронтальній корі [47], або знижену щільність олігодендроглії [ 54-56,58,59].
При шизофренії втрата астроглії є суперечливою знахідкою [48,150]. У той час як деякі дослідження не показали значної втрати астроглії [42,50,51], деякі інші виявили знижену щільність астроглії [37,38,43,44,48,49,151] та значне зменшення двох ізоформ GFAP [39]. Непослідовні висновки можуть бути результатом: 1) супутньої патології МДР, яка часто пов’язана з втратою гліальної тканини; 2) вікові варіації, оскільки у пацієнтів старшого віку спостерігається збільшення GFAP-позитивної астроглії [35,42,50]; 3) регіональна [150] та мінливість коркового шару [48]; 4) лікування антипсихотичними препаратами, оскільки експериментальні дослідження показують як знижену [152], так і підвищену [153] астрогліальну щільність, пов’язану з хронічним лікуванням антипсихотиками [70]; і 5) хворобливий стан (наприклад, суїцидальна проти несуїцидальної поведінки) [154]. Посмертні дослідження задокументували втрату олігодендроглії [54,56,60-65,148,155,156], зокрема в префронтальній корі, передній поясній корі та гіпокампі [148]. Ультраструктурне дослідження префронтальної області показало аномально мієлінові волокна як у сірій, так і в білій речовині; як вік, так і тривалість захворювання позитивно корелювали з аномаліями білої речовини [157].
На відміну від нейродегенеративних розладів, які зазвичай асоціюються з проліферацією астроглії [136], психіатричні розлади асоціюються зі зниженою або незмінною щільністю астроглії [138]. Відсутність підвищеної гліальної щільності при психічних розладах з раннім початком [44,138] може відображати більш повільну швидкість дегенеративного прогресування психічних захворювань [138].
Ми постулюємо, що дегенеративні зміни, пов’язані з психічними розладами, є більш тонкими і недостатньо серйозними, щоб спровокувати астрогліальні внутрішньоклітинні фактори транскрипції, які позитивно регулюють астрогліоз, включаючи активатор сигнального перетворювача транскрипції 3 і ядерний фактор каппа B (NF-?B) [136].
У той час як більшість патологоанатомічних досліджень зосереджені на зміні щільності гліальної тканини при БДР, БЛД та шизофренії, інші описували зміну морфології гліальних клітин зі змішаними висновками. При MDD та BPD розмір глії або збільшений, або незмінний [55]. В одному дослідженні було виявлено зменшення розміру глії при БЛД і шизофренії, але не при БДР [43]. Посмертне дослідження пацієнтів із депресією, які вчинили суїцид, виявило збільшення розміру астроглії в передній поясній білій речовині, але не в корі [158]. В одному дослідженні за участю пацієнтів із шизофренією було виявлено помітне зменшення розміру астроглії в шарі V дорсолатеральної префронтальної кори, незважаючи на те, що щільність астроглії вдвічі перевищує щільність астроглії в тому ж шарі [48]. Змішані результати можуть частково відображати попередні дослідження гліальних змін при психіатричних захворюваннях, які не визначали астроглію проти олігодендроглії [148].
Втрата гліалу при психічних захворюваннях може сприяти нейрозапаленню за допомогою кількох механізмів, включаючи аномальні рівні цитокінів (див. розділ про цитокіни), порушення регуляції метаболізму глутамату (див. розділ «Глутамат»), підвищення білка S100B (див. розділ S100B),�і змінена функція ГЕБ (див. розділ Гематоенцефалічний бар’єр), що призводить до порушення пізнання та поведінки [44,45,54,133,159].
Гістопатологія мікроглії
Мікроглія - це резидентні імунні клітини ЦНС. Вони забезпечують постійний імунний нагляд і регулюють синаптичну обрізку розвитку [160,161]. Пошкодження ЦНС перетворює розгалужену мікроглію в стані спокою в активовані подовжені паличкоподібні та макрофагоподібні фагоцитарні амебоїдні клітини, які проліферують і мігрують до місця пошкодження вздовж хемотаксичних градієнтів (тобто активація та проліферація мікроглії (MAP)) [161]. Клітини мікроглії людини експресують NMDAR, які можуть опосередковувати MAP, що призводить до пошкодження нейронів [162].
При БДР, БЛД та шизофренії результати патологоанатомічних досліджень, які досліджують наявність МАП, неоднозначні. Патологоанатомічні дослідження виявили підвищений MAP лише в одного з п’яти пацієнтів з MDD [67]. У деяких пацієнтів з розладом БЛД було задокументовано збільшення мікроглії, позитивної на лейкоцитарний антиген-DR-позитивну мікроглію людини, що демонструє потовщені відростки у лобній корі [69]. При шизофренії, хоча в деяких дослідженнях повідомлялося про підвищення МАР порівняно з контролем, інші не показали ніякої різниці між групами [22,67,70]. У патоморфологічному дослідженні з оцінкою MAP при MDD та BPD; Щільність клітин мікроглії з позитивною хіноліновою кислотою була підвищена в підгенуальній передній поясній корі та передній середній поясній корі у пацієнтів з МДР та БЛД, які покінчили життя самогубством порівняно з контрольною групою [53]. Постійний аналіз показав, що це підвищення MAP було пов’язано виключно з MDD, а не з BPD, оскільки позитивне мікрогліальне імунне фарбування у суб’єктів MDD було значно вищим, ніж у підгрупі BPD як у підколіновій передній поясній та середній мозковій корі, а оскільки щільність мікроглії була однаковою як у BPD, так і в контрольних групах [53]. Дослідження, в якому порівнювалися всі три розлади (дев’ять MDD, п’ять BPD, чотирнадцять шизофренії, десять здорових осіб контролю), не продемонструвало суттєвої різниці в щільності мікроглії в чотирьох групах [68].
Ці неоднозначні результати можна пояснити змінними мікрогліальними імунологічними маркерами, які використовувалися в різних дослідженнях [70], та/або неможливістю контролювати тяжкість захворювання [22,53,68]. Примітно, що три патологоанатомічні дослідження пацієнтів із МДР та шизофренією задокументували сильну позитивну кореляцію між MAP та суїцидальністю в передній поясній корі та медіодорсальному таламусі, незалежно від психіатричного діагнозу [22,53,68]. Таким чином, MAP може бути станом, а не маркером ознаки для MDD та шизофренії.
При ОКР моделі на тваринах припускають, що дисфункція та зменшення певних мікрогліальних фенотипів, наприклад тих, що експресують ген Hoxb8, який кодує фактор транскрипції гомеобокс, може спричинити поведінку, подібну до ОКР [71,72].
Нокаутні миші Hoxb8 демонструють надмірну поведінку догляду та тривожність у зв’язку зі зниженою щільністю мікроглії [71,72]. Ця надмірна доглянута поведінка нагадує поведінкові характеристики людського ОКР. Ін’єкція Hoxb8 дорослим мишам з нокаутом Hoxb8 зупиняє втрату мікроглії та відновлює нормальну поведінку [71,72]. Роль цих специфічних мікрогліальних фенотипів у ОКР людини незрозуміла.
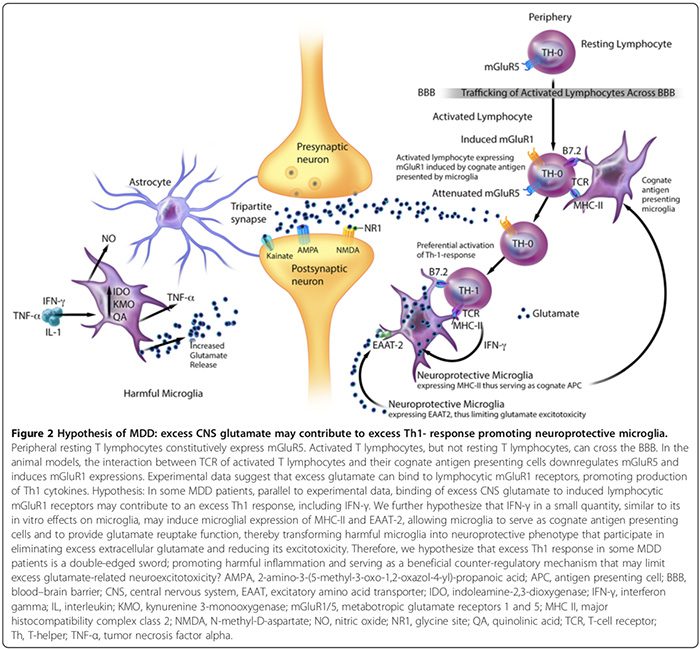
Експериментальні дані свідчать про те, що MAP містить відмінні шкідливі та нейропротекторні фенотипи (рис. 2). Шкідлива мікроглія не експресує головний комплекс гістосумісності II (MHC-II) і, отже, не може діяти як антигенпрезентуючі клітини (APC) [163,164]; вони сприяють шкідливому впливу [17,69,165] через продукцію прозапальних цитокінів, передачу сигналів синтази оксиду азоту [17,166], сприяючи експресії гліальної та BBB-перицитної/ендотеліальної циклооксигенази-2 (COX-2) [167], індукуючи секрет S100B100B17,136,168,169 (S2B2B2). розділ) та вивільнення глутамату мікроглії [29]. Шкідлива мікроглія також виділяє простагландин Е-2 (PGE-2), який сприяє виробленню прозапальних цитокінів, що, у свою чергу, підвищує рівень PGE-2 у циклі прямої подачі [29]. Крім того, PGE-XNUMX стимулює експресію ЦОГ-XNUMX, яка опосередковує перетворення арахідонової кислоти в PGE-XNUMX, створюючи інший цикл прямої подачі [XNUMX].
Нейропротекторна мікроглія, навпаки, може: 1) експресувати MHC-II in vivo та in vitro [163,166] і діяти як споріднений APC (Малюнок 2) [163,164,166]; 2) полегшити загоєння та обмежити пошкодження нейронів, сприяючи секреції протизапальних цитокінів [17], нейротрофічного фактора головного мозку [17] та інсуліноподібного фактора росту-1 [166]; і 3) експресують збудливий амінокислотний транспортер-2 (EAAT2), який усуває надлишок позаклітинного глутамату [163,166] і сприяє нейропротекторному Т-лімфоцитарному аутоімунітету (Малюнок 2) [163,164]. Однак необхідні додаткові дослідження, щоб підтвердити роль нейропротекторної мікроглії до нейропсихічних розладів у людей.
В пробірці Дослідження на тваринах показують, що на співвідношення шкідливої та нейропротекторної мікроглії може впливати чистий ефект запальних контррегуляторних механізмів [15,74,164,166]. Ці механізми включають кількість нейропротекторних CD4+CD25+FOXP3+ T-регуляторних клітин ((T regs) Рисунок 1) [15,74,164,166] та рівні цитокінів мозку; низький IFN-? рівні можуть сприяти нейропротекторної мікроглії (Малюнок 2) [166], тоді як високі рівні можуть сприяти розвитку шкідливого фенотипу [166].
Роль цитокінів
До прозапальних цитокінів належать IL-1?, IL-2, IL-6, TNF-? та ІФН-?. Вони секретуються переважно мікроглією, лімфоцитами Th1 та моноцитами/макрофагами фенотипу M1 (Малюнок 1) [15,170]. Вони сприяють шкідливому запаленню. Протизапальні цитокіни включають ІЛ-4, ІЛ-5 та ІЛ-10. Вони в основному виділяються астроглієюЛімфоцити Th2, моноцити/макрофаги фенотипу T і M2 [15,52,74]. Вони можуть обмежити шкідливе запалення [15,74] шляхом перетворення прозапального M1-фенотипу в корисний протизапальний M2-фенотип [15] і потенційно шляхом стимулювання нейропротекторного мікрогліального фенотипу [15,17,74,163,166]. Роль прозапальних/протизапальних цитокінів у психіатричних розладах підтверджується кількома доказами (рис. 1, таблиця 2) [15,17,29,52,74].
У MDD останній мета-аналіз (29 досліджень, 822 MDD, 726 здорових контрольних осіб) сироваткових прозапальних цитокінів підтвердив, що розчинні рецептори IL-2, IL-6 і TNF-? рівні підвищені в MDD (маркерах ознак) [91], тоді як IL-1?, IL-2, IL-4, IL-8 та IL-10 статистично не відрізняються від контролю [91]. У первинному дослідженні цитокінів, у якому порівнювалися підгрупи MDD (47 суїцидальних MDD, 17 несуїцидальних MDD, 16 осіб контролю здоров'я), обидві сироватки IL-6 і TNF-? були значно вищими, в той час як рівні IL-2 були значно нижчими у суб'єктів MDD, які покінчили життя самогубством, порівняно з обома іншими групами [96]. Цей висновок свідчить про те, що IL-6 та TNF-? є також маркерами стану МДД [96]. Зниження рівня IL-2 у сироватці крові, пов’язане з гострою суїцидальною поведінкою, може відображати посилене зв’язування з його активованим рецептором у мозку; паралельно з вищезгаданим мета-аналізом, який показує збільшення розчинного рецептора IL-2 у MDD [91]. Дослідження з вивчення клінічної значущості цитокінів при БДР показали, що рівні цитокінів у сироватці крові підвищуються під час гострих депресивних епізодів [171,172] і нормалізуються після успішного, але не безуспішного лікування антидепресантами [17] та електросудомної терапії [29]; ці дані свідчать про можливу патогенну роль цитокінів.
При БЛД зміни цитокінів сироватки були підсумовані в нещодавньому огляді; TNF-?, IL-6 та IL-8 підвищуються під час маніакальних та депресивних фаз, тоді як IL-2, IL-4 та IL-6 підвищуються під час манії [92]. Інші дослідження показали, що сироватки IL-1? і рівні рецепторів IL-1 статистично не відрізняються від здорових контрольних осіб [92], хоча дослідження тканин задокументували підвищення рівня IL-1? і рецептор IL-1 у лобній корі головного мозку BPD [69].
При шизофренії результати досліджень, що вивчають аномалії цитокінів, суперечливі (табл. 2). У той час як деякі дослідження виявили як зниження прозапальних цитокінів у сироватці крові (IL-2, IFN-?), так і підвищення рівня протизапальних цитокінів у сироватці та спинномозковій рідині (IL-10) [52], інші виявили підвищення рівня про- та протизапальних цитокінів у сироватці крові з домінуванням прозапального типу [22,173,174, 62]. ]. Один метааналіз цитокінів (2,298 дослідження, 858 шизофренії, 1 здорових представників контролю) показав підвищені рівні антагоніста IL-2R, sIL-6R та IL-174 [52]. Однак у цьому дослідженні не було враховано застосування нейролептиків, які, як вважають, посилюють продукцію прозапальних цитокінів [40]. Останній мета-аналіз цитокінів (2,572 досліджень, XNUMX шизофренії,�4,401 контроль), які враховували антипсихотичні засоби, виявили, що TNF-?, IFN-?, IL-12 і sIL-2R постійно підвищуються при хронічній шизофренії незалежно від активності захворювання (маркери ознак), тоді як IL-1?, IL-6 та трансформуючий фактор росту бета позитивно корелює з активністю захворювання (маркери стану)[173]. Клітинні культури мононуклеарних клітин периферичної крові (PBMC), отримані від хворих на шизофренію, продукували більш високий рівень IL-8 та IL-1? спонтанно, а також після стимуляції ЛПС, що свідчить про роль активованих моноцитів/макрофагів у патології шизофренії [175].
При ОКР результати випадкового дослідження сироваток і цитокінів у спинномозковій рідині, а також дослідження МПК, стимульованих ЛПС, є суперечливими [93-95,176-179]. Існує кореляція між OCD та функціональним поліморфізмом у промоторній області TNF-? гена [34], хоча малопотужні дослідження не підтвердили цю асоціацію [180]. Таким чином, результати досліджень, що підтверджують збільшення або зниження TNF-? Рівні цитокінів [93,176-178] можуть відображати їх варіабельне включення підгрупи суб'єктів ОКР з цим конкретним поліморфізмом у їхніх когортах.
Поляризація цитокінової реакції при великій депресії та шизофренії
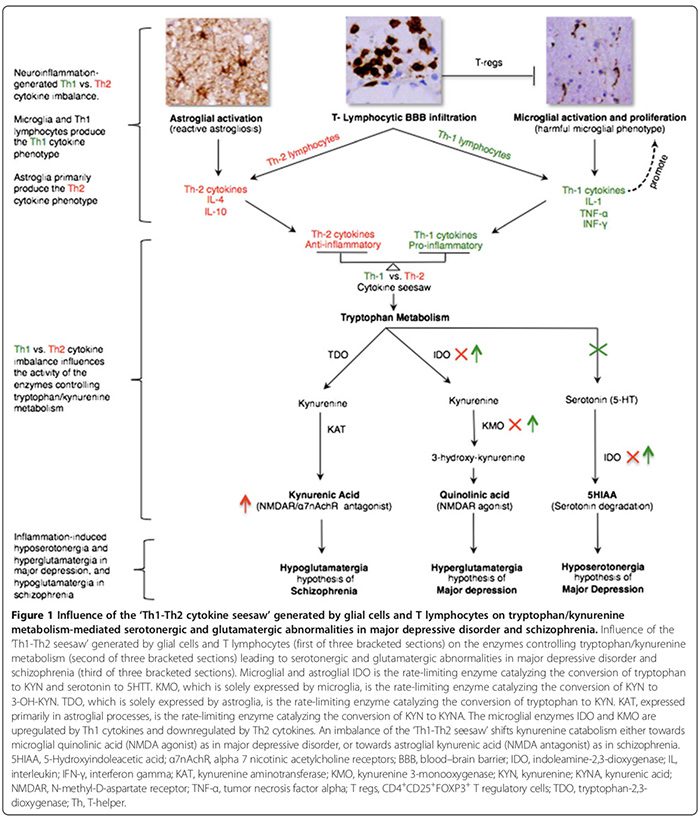
Фенотипи цитокінової відповіді класифікуються як прозапальні Th1 (IL-2, IFN-?) або протизапальні Th2 (IL-4, IL-5, IL-10) відповідно до імунних функцій, які вони регулюють. У той час як цитокіни Th1 регулюють клітинно-опосередкований імунітет, спрямований проти внутрішньоклітинних антигенів, цитокіни Th2 регулюють гуморальний імунітет, спрямований проти позаклітинних антигенів [29,52]. Цитокіни Th1 продукуються лімфоцитами Th1 і моноцитами M1, тоді як цитокіни Th2 продукуються лімфоцитами Th2 і моноцитами M2 [29,52]. У мозку мікроглія переважно секретує цитокіни Th1, тоді як астроглія переважно секретує цитокіни Th2 [29,52]. На взаємне співвідношення цитокінів Th1:Th2, відтепер «гойдалок Th1-Th2», впливає частка активованої мікроглії (надлишок Th1) до астроглії (надлишок Th2) і взаємодія між активованими Т-клітинами та надмірними рівнями глутамату в ЦНС, про яку ми припускали. на користь відповіді Th1 (Малюнок 2) [29,163,166].
Дисбаланс Th1-Th2 гойдалок може впливати на метаболізм триптофану, змінюючи його ферменти [21,52], тим самим зміщуючи катаболізм триптофану в бік кінуреніну (KYN) і катаболізму KYN в бік будь-якого з двох його метаболітів, що знаходяться нижче за ходом; хінолінова кислота мікроглії, яка опосередкована Th1-реакцією, або астрогліальна кінуренова кислота (KYNA) (Малюнок 1), яка опосередкована Th2-реакцією [21,29,170].
Ферменти метаболізму триптофану, на які впливає Th1-Th2 гойдалка, включають (Малюнок 1): індолеамін-2,3-діоксигеназу (IDO), що експресується мікроглією та астроглією, ферменти, що обмежують швидкість, які опосередковують перетворення триптофану в KYN і серотоніну в 5- гідроксиіндоліцтова кислота[21,29]. Кінуренін-3-монооксигеназа (KMO), що експресується виключно мікроглією, є ферментом, що обмежує швидкість, який перетворює KYN на 3-гідроксикінуренін (3-OH-KYN), який далі метаболізується до хінолінової кислоти [21,29]. Триптофан-2,3-діоксигеназа (TDO), що експресується виключно астроглією, є ферментом, що обмежує швидкість перетворення.триптофану до KYN [21,29]. Кінуренінамінотрансфераза (КАТ), що експресується переважно в астрогліальних процесах, є ферментом, що обмежує швидкість, що опосередковує перетворення KYN в KYNA [21,29].
Цитокіни Th1 активують мікрогліальний IDO і KMO, зміщуючи мікрогліальний катаболізм KYN у бік хінолінової.синтез кислоти (агоніст NMDAR), тоді як цитокіни Th2 інактивують мікрогліальний IDO та KMO, зміщуючи астрогліальний катаболізм KYN у бік синтезу KYNA, опосередкованого TDO та KAT (антагоніст NMDAR) (рис. 1) [21,29].
Імунофенотипи, що переважають Th1 і Th2, були запропоновані для MDD та шизофренії, відповідно, на основі периферичних, а не ЦНС, моделей цитокінів [52,173]. Ми вважаємо, що моделі периферичних цитокінів є ненадійними сурогатними маркерами тих, що знаходяться в ЦНС. Дійсно, на рівні периферичних цитокінів можуть впливати багато змінних поза ЦНС, які постійно не контролюються в кількох дослідженнях периферичних цитокінів, зокрема: 1) вік, індекс маси тіла, психотропні препарати, куріння, стрес і циркадні коливання; 2) вплив�активність/стан захворювання на синтез виділених цитокінів [95,173]; 3) вплив психотропних засобів на вироблення цитокінів [52]. Короткий період напіввиведення та швидкий обмін сироваткових цитокінів [181] (наприклад, 18 хвилин для TNF-? [182] проти 60 хвилин для IL-10 [183]) можуть додатково обмежити надійність інтерпретації їх рівні, виміряні на основі випадкового відбору сироваток.
У МДР існує консенсус, що прозапальна відповідь імунофенотипу Th1 переважає (табл. 2) [17,29]. Високі рівні хінолінової кислоти в головному мозку посмертної МДР [53] свідчать про наявність посиленої реакції Th1 (Малюнок 1) [21,29]. Підвищений рівень хінолінової кислоти в ЦНС може сприяти апоптозу людської астроглії, опосередкованому припливом кальцію [184], що гіпотетично може притупити�Th2-реакція, отримана з астроглії [29], схиляючи Th1 проти Th2 гойдалки на користь мікрогліальної відповіді Th1. Гіпосеротонінергія ЦНС [29] додає додаткову підтримку надмірній відповіді Th1, яка, як показано, знижує синтез серотоніну в ЦНС [185] та посилює його деградацію (Малюнок 1) [21,29].
Гіперглутаматергія ЦНС також може сприяти надлишковій відповіді Th1 в мозку (Малюнок 2). Дослідження in vitro показує, що периферичні Т-лімфоцити в стані спокою конститутивно експресують метаботропний глутаматний рецептор 5 (mGluR5) [164], зв’язування якого з глутаматом пригнічує вивільнення ІЛ-6 лімфоцитами, таким чином пригнічуючи проліферацію аутореактивних Т-ефекторних клітин 164 [37]. Активовані Т-лімфоцити, але не Т-лімфоцити в стані спокою, можуть перетинати ГЕБ [XNUMX].
Експериментальні дані свідчать про те, що взаємодія між Т-клітинними рецепторами активованих Т-лімфоцитів та їхніми спорідненими антигенпрезентуючими клітинами може знижувати регуляцію mGluR5 та індукувати експресію mGluR1 [164]. На тваринних моделях зв'язування надлишку глутамату з лімфоцитарними рецепторами mGluR1 сприяє виробленню цитокінів Th1, включаючи IFN-? [164].
Ми припускаємо, що у деяких пацієнтів з MDD, паралельно з експериментальними даними [164], зв’язування надлишку глутамату ЦНС з індукованими лімфоцитарними рецепторами mGluR1 може сприяти надлишковій відповіді Th1, включаючи IFN-? (Малюнок 2). Ми припускаємо, що IFN-? у невеликій кількості, подібно до його впливу in vitro на мікроглію [166], може індукувати мікрогліальну експресію MHC-II і EAAT2 [163,166], дозволяючи мікроглії служити спорідненими клітинами, що представляють антиген, і забезпечувати функцію зворотного захоплення глутамату [163,164,166], таким чином перетворюючи шкідливу мікроглію в нейропротекторний фенотип [163,166], який бере участь у усуненні надлишку позаклітинного глутамату [163,164,166]. Тому ми також припускаємо, що надлишок Th1-реакції у підгрупах пацієнтів з MDD є палицею з двома кінцями, що сприяє шкідливому запаленню та служить корисним контррегуляторним механізмом, який може обмежити надлишок нейроексайтотоксичності, пов’язаної з глутаматом (Малюнок 2).
При шизофренії, хоча деякі дослідження периферичних цитокінів свідчать про переважання протизапального Th2 імунофенотипу/відповіді [52], інші спростовують це [173,174]. Проте ми згодні з авторами, які висунули гіпотезу, що Th2-реакція є домінуючим фенотипом при шизофренії [52]. Підвищений рівень KYNA у мозку, спинномозковій рідині та сироватці крові [21,52] свідчить про зниження регуляції мікрогліальних IDO та KMO, що є функцією Th2-реакції, яка зміщує астрогліальний катаболізм KYN у бік синтезу KYNA (Малюнок 1) [21,52]. Знижена активність KMO та експресія мРНК KMO в мозку шизофренії після смерті [73] узгоджується з надлишковою відповіддю Th2 (рис. 1). Підвищена поширеність Th2-опосередкованих аномалій гуморального імунітету у підгрупах хворих на шизофренію, про що свідчить збільшення кількості В-клітин [21,76], збільшення.Продукція аутоантитіл, включаючи противірусні антитіла [76] та підвищений імуноглобулін Е [52], додає додаткову підтримку гіпотезі домінування відповіді Th2.
Нейрозапалення та порушення регуляції глутамату ЦНС
Глутамат опосередковує пізнання та поведінку [186]. Рівні синаптичного глутамату регулюються високоафінними натрій-залежними гліальними та нейрональними EAAT, а саме XAG-системою, відповідальною за зворотне захоплення глутамату/вивільнення аспартату [137,164] та натрій-незалежною астроглійною системою глутамат/цистин (Xc-) відповідає за вивільнення глутамату/зворотне захоплення цистину [164]. Астрогліальні EAAT1 і EAAT2 забезпечують більше 90% повторного поглинання глутамату [79].
Нейрозапалення може змінити метаболізм глутамату та функцію його транспортерів [15,29,187,188], спричиняючи когнітивні, поведінкові та психіатричні порушення [15,21,29,79,186,188,189]. Аномалії функції/експресії EAAT і метаболізму глутамату при БДР, БЛД, шизофренії та ОКР узагальнено в таблиці 2.
При МДД є дані про коркову гіперглутаматергію (табл. 2). Рівень кортикального глутамату позитивно корелював із тяжкістю симптомів депресії, а п’ятитижневий курс антидепресантів знижував концентрацію глутамату в сироватці крові [85,86]. Одноразова доза кетаміну, потужного антагоніста NMDAR, може повернути рефрактерну MDD протягом тижня [17,21,29,85]. Надмірні рівні глутамату в ЦНС можуть викликати запалення, опосередковане нейротоксичністю [163,164,188, 1, 2], включаючи прозапальну відповідь Th164 (Малюнок XNUMX) [XNUMX].
Обмежені докази in vitro свідчать про те, що запальні/прозапальні цитокіни можуть підвищувати рівні глутамату в ЦНС [188] у циклі прямого зв’язку за допомогою кількох потенційних механізмів: 1) прозапальні цитокіни можуть інгібувати [15,17,168] та реверсувати [45,137] астрогліальну глута-медіалутану EA. функція зворотного захоплення; 2) прозапальні цитокіни можуть посилювати мікрогліальний синтез хінолінової кислоти [53], яка, як було експериментально показано, сприяє вивільненню синаптосомного глутамату [15,17,29,190]; 3) підвищення ЦОГ-2/ПГЕ-2 і ФНП-? рівні можуть індукувати приплив кальцію [137], який, ґрунтуючись на даних in vitro, може збільшити вивільнення астрогліального глутамату та D-серину [191]; і 4) активована мікроглія може експресувати надлишок Xc-антипортерних систем, які опосередковують вивільнення глутамату [164,192].
При шизофренії виявляється префронтальна кортикальна гіпоглутаматергія [87,90,193,194] (табл. 2) та знижена функціональність NMDAR [5]. Нещодавній метааналіз H1 магнітно-резонансної спектроскопії (MRS) (28 досліджень, 647 шизофренія, 608 контроль) підтвердив зниження рівня глутамату та підвищення рівня глутаміну в медіальній лобній корі [90]. Роль запалення до гіпоглутаматергії не доведена. Підвищений синтез KYNA в мозку при шизофренії [21,52], як правило, функція Th2-реакції (Малюнок 1), може інгібувати субодиницю NR1 NMDAR і альфа-7 нікотинової речовини.рецептор ацетилхоліну (?7nAchR) [195], що призводить до зниження функції NMDAR і зменшення опосередкованого ?7nAchR вивільнення глутамату [195].
При БЛД та ОКР дані свідчать про гіперглутаматергію кори ЦНС при обох захворюваннях (табл. 2) [78,84,88,131]. Внесок запалення (BPD та OCD) та аутоантитіл (OCD) [7,77,84,88,130] у підвищення рівня глутамату в ЦНС потребує подальшого дослідження.
Роль S100B
S100B – це білок, що зв’язує кальцій 10 кДа, що виробляється клітинами астроглії, олігодендроглії та епендимальних клітин судинного сплетення [196]. Він опосередковує свій вплив на навколишні нейрони та глію через рецептор кінцевого продукту глікації [196]. Наномолярні позаклітинні рівні S100B забезпечують сприятливий нейротрофічний ефект, обмежують пов'язане зі стресом пошкодження нейронів, пригнічують мікрогліальний TNF-? вивільнення та збільшення зворотного захоплення астрогліального глутамату [196]. Мікромолярні концентрації S100B, переважно вироблені активованою астроглією та лімфоцитами [196,197], мають шкідливі ефекти, що передаються рецептором кінцевого продукту глікації, що включає апоптоз нейронів, продукцію ЦОГ-2/PGE-2, IL-1? та індукованих видів оксиду азоту, а також підвищення рівня моноцитарного/мікрогліального TNF-? секреція [21,196,198].
Рівні S100B у сироватці крові та, зокрема, у спинномозковій рідині та тканинах мозку є індикаторами гліальної (переважно астрогліальної) активації [199]. При БДР та психозах рівень S100B у сироватці крові позитивно корелює з тяжкістю суїцидальності, незалежно від психіатричного діагнозу [200]. Посмертний аналіз S100B показав зниження рівнів у дорсолатеральній префронтальній корі MDD та BPD та підвищення рівнів у тім’яній корі BPD [196].
Метааналіз (193 розлади настрою, 132 здорові особи контролю) підтвердив підвищення рівня S100B у сироватці крові та спинномозкової рідини при розладах настрою, особливо під час гострих депресивних епізодів та манії [201].
При шизофренії рівень S100B у мозку, спинномозковій рідині та сироватці крові підвищений [199,202]. Метааналіз (12 досліджень, 380 шизофренії, 358 здорових представників контролю) підтвердив підвищення рівня S100B у сироватці крові при шизофренії [203]. У посмертних мозках суб’єктів шизофренії S100B-імунореактивна астроглія виявляється в областях, причетних до шизофренії, включаючи передню поясну кору, дорсолатеральну префронтальну кору, орбітофронтальну кору та гіпокамп [154]. Підвищений рівень S100B корелює з параноїдальним [154] та негативістичним психозом [204], порушенням пізнання, поганою терапевтичною реакцією та тривалістю захворювання [202]. Генетичний поліморфізм у S100B [32] та рецепторі генів кінцевих продуктів глікації в когортах шизофренії (Таблиця 2) [32,33,205] припускає, що ці аномалії, ймовірно, первинні/патогенні, а не вторинні/біомаркери. Справді, зниження рівня S100B у сироватці крові після лікування антидепресантами [201] та антипсихотичними засобами [196] свідчить про �деяке клінічне значення S100B для патофізіології психічних розладів.
Нейрозапалення та підвищений окислювальний стрес
Окислювальний стрес – це стан, при якому надлишок окислювачів пошкоджує або модифікує біологічні макромолекули, такі як ліпіди, білки та ДНК [206-209]. Цей надлишок є результатом збільшення вироблення окислювача, зниження елімінації окислювача, неповноцінного антиоксидантного захисту або певної комбінації цього [206-209]. Мозок особливо вразливий до окислювального стресу через: 1) підвищену кількість поліненасичених жирних кислот, що піддаються пероксидації; 2) відносно високий вміст мікроелементів, що індукують перекисне окислення ліпідів і кисневих радикалів (наприклад, заліза, міді); 3) високе використання кисню; і 3) обмежені механізми антиокислення [206,207].
Надмірний окислювальний стрес може виникати при БДР [206], БЛД [206,207], шизофренії [207,209] та ОКР [206,208]. Периферичні маркери окислювальних порушень включають збільшення продуктів перекисного окислення ліпідів (наприклад, малонового діальдегіду та 4-гідрокси-2-ноненалю), збільшення метаболітів оксиду азоту (NO), зниження рівня антиоксидантів (наприклад, глутатіону) та змінених рівнів антиоксидантних ферментів [206,207].
При MDD збільшення виробництва аніон-радикалів супероксиду корелює зі збільшенням опосередкованого окисленням апоптозу нейтрофілів [206]. Рівні антиоксидантних ферментів (наприклад, супероксиддисмутази-1) у сироватці крові підвищуються під час гострих депресивних епізодів і нормалізуються після лікування селективними інгібіторами зворотного захоплення серотоніну (СІЗЗС) [206]. Це свідчить про те, що при БДР рівень антиоксидантного ферменту в сироватці крові є маркером стану, який може відображати компенсаторний механізм, який протидіє гострому підвищенню окисного стресу. [206]. При шизофренії, навпаки, рівень розчинної супероксиддисмутази-1 у спинномозковій рідині значно знижений у пацієнтів з раннім початком шизофренії порівняно з пацієнтами з хронічною шизофренією та здоровими контрольною групою. Це свідчить про те, що знижений рівень антиоксидантного ферменту мозку може сприяти окислювальному пошкодженню при гострій шизофренії [210], хоча для підтвердження цього висновку необхідні більш масштабні дослідження.
Кілька додаткових експериментальних досліджень і досліджень на людях більш детально вивчали механізми, що лежать в основі патофізіології підвищеного окисного стресу при психічних розладах [206-262]. У тваринних моделях депресії рівень глутатіону в мозку знижений, тоді як перекисне окислення ліпідів і рівень NO збільшуються [206,262].
Посмертні дослідження показують знижений рівень загального глутатіону в мозку у пацієнтів з БДР, БЛД [206] та шизофренічних осіб [206,207, 262]. Фібробласти, культивовані у пацієнтів з MDD, демонструють підвищений окислювальний стрес незалежно від рівня глутатіону [XNUMX], що заперечує основну роль виснаження глутатіону як основного механізму окисного стресу при депресії.
Активація мікроглії може підвищити окислювальний стрес через вироблення нею прозапальних цитокінів і NO [206-209]. Прозапальні цитокіни та високі рівні NO можуть сприяти утворенню активних форм кисню (АФК), що, у свою чергу, прискорює перекисне окислення ліпідів, пошкоджуючи мембранні фосфоліпіди та їх мембранно-зв’язані рецептори моноамінових нейромедіаторів та виснажуючи ендогенні антиоксиданти. Підвищені продукти АФК можуть посилити активацію мікроглії та збільшити прозапальну продукцію через стимуляцію NF-?B [208], що, у свою чергу, продовжує окислювальне пошкодження [208], створюючи потенціал для патологічної петлі позитивного зворотного зв’язку при деяких психіатричних розладах [206-209]. Хоча нейрозапалення може підвищити рівень глутамату в мозку [85,86], роль глутаматергічної гіперактивності як причини окисного стресу залишається необґрунтованою [207].
Мітохондріальна дисфункція може сприяти підвищенню окисного стресу при БДР, БЛД та шизофренії [206]. Посмертні дослідження цих розладів виявляють аномалії мітохондріальної ДНК, що узгоджується з високою поширеністю психічних розладів у первинних мітохондріальних розладах [206]. Дослідження на тваринах in vitro показують, що прозапальні цитокіни, такі як TNF-?, можуть знижувати щільність мітохондрій і погіршувати окислювальний метаболізм мітохондрій [211,212], що призводить до збільшення продукції АФК [206,213]. Ці експериментальні результати можуть свідчити про механістичні зв’язки між нейрозапаленням, мітохондріальною дисфункцією та окислювальним стресом [206,213], що заслуговує подальшого дослідження цих перетинаються патогенних шляхів у психічних розладах людини.
Уразливість нервової тканини до окисного пошкодження варіюється в залежності від психічних розладів залежно від нейроанатомічних, нейрохімічних і молекулярних шляхів, залучених до конкретного розладу [207]. Ефекти лікування також можуть мати вирішальне значення, оскільки попередні дані свідчать про те, що антипсихотичні засоби, СІЗЗС та стабілізатори настрою мають антиоксидантні властивості [206,207,262]. Терапевтичну роль допоміжних антиоксидантів (наприклад, вітамінів С і Е) при психічних розладах ще потрібно обґрунтувати потужними рандомізованими клінічними дослідженнями. N-ацетилцистеїн демонструє найбільш багатообіцяючі результати на сьогоднішній день: кілька рандомізованих плацебо-контрольованих досліджень продемонстрували його ефективність при БДР, БЛД та шизофренії [207].
Дисфункція гематоенцефалічного бар’єру
BBB забезпечує імунний статус мозку, обмежуючи надходження периферичних медіаторів запалення, включаючи цитокіни та антитіла, які можуть порушувати нейротрансмісію [214,215]. Гіпотеза руйнування ГЕБ та його роль у деяких психіатричних пацієнтів [60,214,216,217] узгоджується зі збільшенням поширеності супутньої психіатричної патології при захворюваннях, пов’язаних з його дисфункцією, включаючи СЧВ [97], інсульт [11],�епілепсія [218] та аутоімунний енцефаліт (табл. 1). Підвищений «відношення СМЖ:сироватковий альбумін» у пацієнтів з БДР та шизофренією свідчить про підвищену проникність ГЕБ [214].
В одному дослідженні (63 психіатричні суб’єкти, 4,100 контрольних осіб) аномалії спинномозкової рідини, що вказують на ураження ГЕБ, були виявлені у 41% психіатричних суб’єктів (14 MDD та BPD, 14 шизофренії), включаючи інтратекальний синтез IgG, IgM та/або IgA, легкий плеоцитоз спинномозкової рідини (5-8 клітин на мм3) і наявність до чотирьох олігоклональних смуг IgG [216]. Одне посмертне ультраструктурне дослідження при шизофренії виявило ультраструктурні аномалії ГЕБ у префронтальній і зоровій корі, які включали вакуолярну дегенерацію ендотеліальних клітин, астроглійно-кінцеві відростки стопи, а також потовщення та нерівність базальної пластинки [60]. Однак у цьому дослідженні автори не коментували потенційний внесок посмертних змін у їхні висновки. Інше дослідження, що вивчало транскриптоміку ендотеліальних клітин BBB в мозку шизофренії, виявило значні відмінності між генами, що впливають на імунологічну функцію, які не були виявлені в контрольній групі [217].
Опосередкована окисленням ендотеліальна дисфункція може сприяти патофізіології дисфункції ГЕБ при психічних розладах. Непрямі дані клінічних та експериментальних досліджень при депресії [219] і, меншою мірою, при шизофренії [220] свідчать про те, що підвищене окислення може сприяти ендотеліальній дисфункції. Ендотеліальна дисфункція може бути загальним механізмом, що пояснює відомий зв’язок між депресією та серцево-судинними захворюваннями [219,221], що може бути пов’язано зі зниженням рівня вазодилататора NO [221-223]. Експериментальні дослідження показують, що знижені рівні ендотеліального NO механічно пов’язані з від’єднанням ендотеліальної синтази оксиду азоту (eNOS) від її необхідного кофактора тетрагідробіоптерину (BH4), зміщуючи його субстрат з L-аргініну на кисень [224-226]. Незв'язаний eNOS сприяє синтезу АФК (наприклад, супероксиду) і реактивних форм азоту (RNS) (наприклад, пероксинітриту; продукт взаємодії супероксиду з NO) [227], а не NO, що призводить до опосередкованої окисленням дисфункції ендотелію [ 224-226].
Дані на тваринах показали, що СІЗЗС можуть відновлювати дефіцит ендотеліального рівня NO [219], що свідчить про те, що антиоксидантні механізми можуть сприяти їх антидепресивному ефекту. У людей L-метилфолат може посилювати антидепресивні ефекти СІЗЗС [228], імовірно, за рахунок підвищення рівня BH4, який є важливим кофактором для опосередкованого відновленням eNOS антиокислення [229], а також для швидкості -обмежують ферменти синтезу моноамінів (тобто серотоніну, норадреналіну, дофаміну) [228].
У сукупності, як нещодавня робота, яка підкреслює роль несполученого eNOS-індукованого окисного стресу в патогенезі судинних захворювань [230,231], так і �Епідеміологічні дослідження, що встановлюють депресію як незалежний фактор ризику судинних патологій, таких як інсульт і захворювання серця [219,221, 212], додають додаткову підтримку клінічній значущості несполученого eNOS-опосередкованого окислювального пошкодження ендотелію при депресії. Незважаючи на численні докази аномалій цитокінів при психіатричних захворюваннях людини та експериментальні дані, які показують, що прозапальні цитокіни можуть зменшувати експресію eNOS [215] і підвищувати проникність BBB [XNUMX], дані людини, що безпосередньо пов’язують надлишок прозапальних цитокінів із mp та функцією eNOS iBB, є бракує.
Зображення та лікування запалення при психічних захворюваннях
Візуалізація нейрозапалення на місці
Клінічно візуалізація нейрозапалення може виявитися вирішальною для виявлення підгрупи психіатричних пацієнтів з нейрозапаленням, які, швидше за все, сприятливо реагують на імуномодулюючу терапію. Крім того, така візуалізація може дозволити клініцистам контролювати активність захворювання, пов’язаного з нейрозапаленням, та його відповідь на імунну терапію у психіатричних пацієнтів. Зображення запалення в мозку людини традиційно залежало від візуалізації МРТ або КТ екстравагавованих внутрішньовенних контрастних речовин, що вказує на локалізований розпад ГЕБ. МРТ із застосуванням гадолінію інколи демонструє подібні порушення в лімбічних областях, пов’язані з емоційною обробкою у пацієнтів із психічними розладами, пов’язаними з паранеопластичним або іншим енцефалітом [107,109,113]. Однак, наскільки нам відомо, аномальне посилення ніколи не було продемонстровано при будь-якому класичному психіатричному розладі [21,214,232], незважаючи на функціональні [214,216] та ультраструктурні аномалії ГЕБ [60].
Чи можна візуалізувати більш тонке нейрозапалення in vivo при класичних психіатричних розладах, залишається невідомим. Одним з перспективних методів є позитронно-емісійна томографія (ПЕТ) з використанням радіоіндикаторів, таких як C11-PK11195, які зв’язуються з білком-транслокатором, раніше відомим як периферичний бензодіазепіновий рецептор, що експресується активованою мікроглією [233,234].
Використовуючи цей метод, було показано, що пацієнти з шизофренією мають більшу мікрогліальну активацію по всій корі [235] та в гіпокампі під час гострого психозу [236]. Одне дослідження (14 шизофренії, 14 контрольних) не виявило суттєвої різниці між зв’язуванням [11C] DAA1106 при шизофренії та контролем, але пряму кореляцію між зв’язуванням [11C] DAA1106 та тяжкістю позитивних симптомів та тривалістю захворювання при шизофренії [236].
Дослідники з нашого закладу використовували ПЕТ C11-PK11195 для демонстрації запалення бігіпокампа у пацієнта з нервово-психічними порушеннями, включаючи психотичну MDD, епілепсію та антероградну амнезію, пов’язану з антитілами до GAD [237]. Проте PK11195 PET має�низькі властивості сигнал/шум і вимагає вбудованого циклотрона.
Відповідно, дослідження присвячені розробці вдосконалених білкових лігандів транслокатора для ПЕТ та ОФЕКТ. Майбутні потужні посмертні дослідження тканин мозку з використанням кількісної оцінки білків, спрямованих на з’ясування метаболічних і запальних шляхів, цитокінів ЦНС та їх зв’язувальних рецепторів, при психічних розладах необхідні, щоб розширити наше розуміння аутоімунної патофізіології.
Роль протизапальних препаратів при психічних розладах
Декілька досліджень на людях і тваринах показують, що певні протизапальні препарати можуть відігравати важливу допоміжну роль у лікуванні психічних розладів (Таблиця 3). Поширеними препаратами є інгібітори циклооксигенази (табл. 3) [238-245], міноциклін (табл. 3) [240-245], омега-3 жирні кислоти [246,247, 248] і нейростероїди [XNUMX].
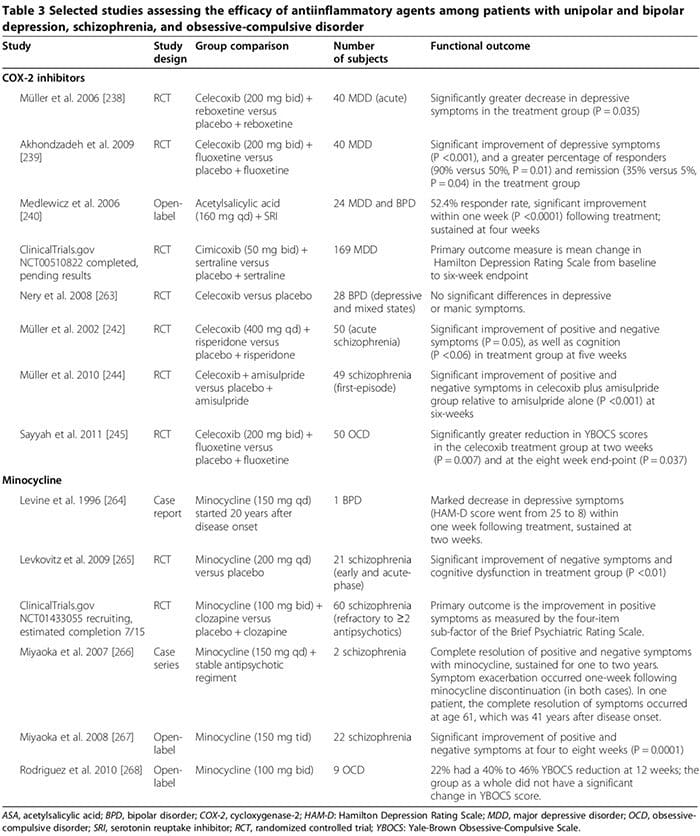 Декілька досліджень на людях показали, що інгібітори ЦОГ-2 можуть покращувати психічні симптоми МДР, БЛД, шизофренії та ОКР (Таблиця 3) [248]. Навпаки, додаткове лікування неселективними інгібіторами ЦОГ (тобто нестероїдними протизапальними препаратами (НПЗП)) може знизити ефективність СІЗЗС [249,250]; У двох великих дослідженнях повідомлялося, що вплив НПЗП (але не селективних інгібіторів ЦОГ-2 або саліцилатів) був пов’язаний зі значним погіршенням депресії серед підгрупи учасників дослідження [249,250].
Декілька досліджень на людях показали, що інгібітори ЦОГ-2 можуть покращувати психічні симптоми МДР, БЛД, шизофренії та ОКР (Таблиця 3) [248]. Навпаки, додаткове лікування неселективними інгібіторами ЦОГ (тобто нестероїдними протизапальними препаратами (НПЗП)) може знизити ефективність СІЗЗС [249,250]; У двох великих дослідженнях повідомлялося, що вплив НПЗП (але не селективних інгібіторів ЦОГ-2 або саліцилатів) був пов’язаний зі значним погіршенням депресії серед підгрупи учасників дослідження [249,250].
У першому дослідженні, в якому взяли участь 1,258 пацієнтів з депресією, які отримували циталопрам протягом 12 тижнів, швидкість ремісії була значно нижчою серед тих, хто приймав НПЗП хоча б один раз, порівняно з тими, хто не приймав (45% проти 55%, OR 0.64, P = 0.0002) [249]. В іншому дослідженні, в якому взяли участь 1,545 суб’єктів МДР, рівень депресії, резистентної до лікування, був значно вищим серед тих, хто приймав НПЗП (OR 1.55, 95% ДІ 1.21–2.00) [231]. Погіршення депресії в групах НПЗП може бути не пов'язане механічно з терапією НПЗП, а пов'язане з супутніми хронічними захворюваннями [10,12-18], які потребують тривалого прийому НПЗП і які, як відомо, незалежно пов'язані з підвищений ризик резистентної до лікування депресії [249,251]. Потрібні майбутні дослідження щодо впливу НПЗП на депресію та реакцію на антидепресанти у людей.
В інших експериментальних дослідженнях з використанням парадигм гострого стресу для індукції депресивного стану у мишей циталопрам підвищував TNF-?, IFN-? і p11 (молекулярний фактор, пов'язаний з депресивною поведінкою у тварин) у лобовій корі, тоді як НПЗП ібупрофен зменшено кількість цих молекул; НПЗЗ також послаблювали антидепресивну дію СІЗЗС, але не інших антидепресантів [249]. Ці результати свідчать про те, що прозапальні цитокіни можуть парадоксальним чином виявляти антидепресивний ефект, незважаючи на переважні докази від �дослідження на людях навпаки (як описано вище), які можуть бути ослаблені НПЗП [249]. Принаймні два міркування можуть пояснити цей очевидний парадокс: 1) за деяких експериментальних умов прозапальні цитокіни пов’язували з нейропротекторною роллю [251; (для �наприклад, IFN-? при низьких рівнях може викликати нейропротекторну мікроглію (Малюнок 2) [163,166,251]); і 2) чи є ці реакції, які спостерігаються в контексті парадигми гострого стресу на тваринній моделі, застосовні до ендогенного МДР у людей, залишається неясним [251].
Терапевтичні ефекти інгібіторів ЦОГ-2 при психічних розладах можуть включати модуляцію біосинтезу простагландинів, похідних від ЦОГ-2, включаючи прозапальний PGE2 і протизапальний 15-дезокси-?12,14-PGJ2 (15d-PGJ2) [252,253]. Інгібітори ЦОГ-2 можуть зменшити запалення, опосередковане PGE2, що може сприяти патофізіології психічних розладів [252,253]. Вони також можуть змінювати рівні 15d-PGJ2 і активність його ядерного рецептора, активованого проліфератором пероксисом ядерного рецептора гамма (PPAR-?) [252,253].
Кілька досліджень показують, що 15d-PGJ2 та його ядерний рецептор PPAR-? можуть служити біологічними маркерами шизофренії [253]. У хворих на шизофренію рівень PGE2 у сироватці крові підвищений, тоді як рівень 15d-PGJ2 у сироватці знижений, як і експресія його ядерного рецептора PPAR-? у PBMC [252]. Хоча інгібітори ЦОГ-2 можуть обмежувати потенційно сприятливий протизапальний ефект ЦОГ-2-залежного �15d-PGJ2/PPAR-? шляху�, вони можуть вигідно зменшити його шкідливі ефекти, включаючи 1) підвищений ризик розвитку інфаркту міокарда та деяких інфекцій (наприклад, цитомегаловірусу та Toxoplasma gondii) у хворих на шизофренію [254] та 2) його проапоптотичні ефекти, що спостерігаються в ракові тканини людини та тварин [255]. Інші потенційні механізми терапевтичного ефекту інгібіторів ЦОГ-2 можуть включати їх здатність знижувати рівні прозапальних цитокінів [163], обмежувати ексайтотоксичність хінолінової кислоти (як при MDD) та знижувати рівні KYNA (як при шизофренії) [128].
Міноциклін може бути ефективним при психічних розладах (табл. 3) [248]. Дані in vitro свідчать про те, що міноциклін інгібує MAP, секрецію цитокінів, «експресію ЦОГ-2/PGE-2» та індукційну синтазу оксиду азоту [256]. Міноциклін також може протидіяти порушеній глутаматергічній і дофамінергічній нейротрансмісії [256].
Ефективність омега-3 жирних кислот при психічних розладах неясна [248]. У метааналізі 2011 року 15 рандомізованих контрольованих досліджень (916 MDD), добавки омега-3, що містять ейкозапентаєнову кислоту ?60% (діапазон доз від 200 до 2,200 мг/день, що перевищує дозу докозагексаенової кислоти), значно зменшували симптоми депресії як додаткова терапія до СІЗС (P <0.001) [246]. Однак подальший метааналіз дійшов висновку, що немає значної користі омега-3 жирних кислот при депресії і що передбачувана ефективність є лише результатом упередженості публікації [247]. Метааналіз 2012 року 5 рандомізованих контрольованих досліджень, що включали 291 учасника BPD, показав, що депресивні, але не маніакальні, симптоми значно покращилися серед тих, хто рандомізовано отримував омега-3 жирні кислоти, порівняно з тими, хто приймав плацебо (Hedges g 0.34, P = 0.025). [257]. У рандомізованому контрольованому дослідженні пацієнтів із шизофренією, які спостерігалися протягом 12 місяців, як позитивні, так і негативні симптоми були значно знижені серед 66 учасників, рандомізованих на довголанцюгові омега-3 (1.2 г/день протягом 12 тижнів; P = 0.02 і 0.01, відповідно) [258]; the�автори дійшли висновку, що збільшення кількості омега-3 під час раннього перебігу шизофренії також може запобігти рецидивам і прогресуванню захворювання [258].
Метааналіз 2012 року семи рандомізованих контрольованих досліджень, що оцінювали збільшення кількості омега-3 у 168 хворих на шизофренію, не виявив користі від лікування [259]. Автори цього метааналізу спеціально зазначили, що не можна зробити висновки щодо кінцевих точок запобігання рецидиву або прогресування захворювання [259]. Експериментальні дані свідчать про те, що ейкозапентаєнова кислота та докозагексаєнова кислота опосередковують свої протизапальні ефекти, сприяючи синтезу резольвінів і протетинів, які можуть пригнічувати інфільтрацію лейкоцитів і зменшувати продукцію цитокінів [248].
Нейростероїди, включаючи прегненолон та його метаболіт алопрегнанолон, можуть мати сприятливу роль у деяких психіатричних розладах [248,260]. У кількох дослідженнях при БДР було виявлено зниження рівнів алопрегнанолону в плазмі/КСФ, що корелює з тяжкістю симптомів, які нормалізувалися після успішного лікування деякими антидепресантами (наприклад, СІЗЗС) та електросудомної терапії [261]. При шизофренії рівень прегненолону в мозку може бути змінений [248], а рівень алопрегнанолону в сироватці крові може підвищитися після прийому деяких антипсихотичних препаратів (наприклад, клозапіну та оланзапіну) [260]. У трьох рандомізованих контрольованих дослідженнях (100 шизофренії (об’єднані); тривалість лікування приблизно дев’ять тижнів) позитивні, негативні та когнітивні симптоми, а також екстрапірамідні побічні ефекти антипсихотичних засобів значно покращилися в одному або кількох дослідженнях серед тих, хто був рандомізований. прегненолон порівняно з тими, хто приймав плацебо [248]. В одному дослідженні покращення було підтримано при тривалому лікуванні прегненолоном [248]. Прегненолон може регулювати пізнання та поведінку шляхом потенціювання функції рецепторів NMDA та GABAA [248]. Крім того, алопрегнанолон може надавати нейропротекторну та протизапальну дію [248]. Щоб підтвердити сприятливу роль нейроактивних стероїдів у психічних розладах у людей на ранніх стадіях, необхідні додаткові дослідження RCT.
Ми очікуємо результатів кількох поточних клінічних випробувань з вивчення терапевтичних ефектів інших протизапальних засобів, включаючи саліцилат, інгібітор NF-?B (NCT01182727); ацетилсаліцилова кислота (NCT01320982); правастатин (NCT1082588); і декстрометорфан, неконкурентний антагоніст NMDAR, який може обмежити спричинене запаленням дофамінергічне ураження нейронів (NCT01189006).
Майбутні стратегії лікування
Хоча сучасні імунні методи лікування (наприклад, IVIG, плазмаферез, кортикостероїди та імуносупресивні засоби) часто ефективні для лікування аутоімунних енцефалітів, при яких запалення є гострим, інтенсивним і переважно адаптивного походження, їх ефективність при класичних психічних розладах, при яких є хронічнізначно м’якше, і переважно вродженого походження, обмежений [2]. Розробка нових терапевтичних засобів має бути спрямована на зворотне втрату гліальної клітини [46,138], зниження регуляції шкідливого MAP, оптимізуючи ендогенні нейропротекторні T regs і корисні MAP, а не безладне придушення запалення, як це відбувається з діючими імуносупресивними агентами. Крім того, необхідна розробка потужних допоміжних антиоксидантів, які б звернули окисне пошкодження при психічних розладах.
Висновки
Аутоімунітет може викликати безліч нервово-психічних розладів, які спочатку можуть проявлятися ізольованими психіатричними симптомами. Вроджене запалення/аутоімунітет може мати значення для патогенезу психіатричних симптомів у підгрупи пацієнтів із класичними психічними розладами. Вроджене запалення може бути механічно пов’язане з традиційними моноамінергічними та глутаматергічними аномаліями та підвищеним окислювальним ушкодженням, про які повідомляють при психіатричних захворюваннях.
Соул Найджар1,5*, Деніел М. Перлман2,5, Кеннет Альпер4, Аманда Найджар3 та Оррін Девінскі1,4,5
Скорочення
3-OH-KYN: 3-гідрокси-кінуренін; ?7nAchR: альфа-7 нікотинові ацетилхолінові рецептори; AMPAR: рецептори аміно-3-гідрокси-5-метил-4-XNUMX-ізоксазолпропіонової кислоти; APC: антигенпрезентуюча клітина; ГЕБ: гематоенцефалічний бар’єр;
BH4: тетрагідробіоптерин; BPD: біполярний розлад; CI: довірчий інтервал;
ЦНС: центральна нервова система; ЦОГ-2: циклооксегеназа-2; СМР: спинномозкова рідина; DSM-IV: Діагностичне та статистичний посібник із психічних розладів 4-е видання; EAAT: транспортери збудливих амінокислот; eNOS: ендотеліальна синтаза оксиду азоту; GABAB: гамма-аміномасляна кислота-бета; GAD: декарбоксилаза глутамінової кислоти; GFAP: гліальний фібрилярний кислий білок; GLX: композит глутамату, глутаміну, гамма-аміномасляної кислоти, що виявляється 1H MRS;
IDO: Індолеамін 2,3-діоксигеназа; Ig: Імуноглобулін; ІЛ: Інтерлейкін; IL-1RA: антагоніст рецепторів інтерлейкіну 1; ІФН-?: інтерферон гамма;
KAT: кінуренінамінотрансфераза; КМО: кінуренін 3-монооксигеназа; KYN: кінуренін; KYNA: кінуренова кислота; LE: Лімбічний енцефаліт;
LPS: ліпополісахарид; КАРТА: активація та проліферація мікроглії;
MDD: великий депресивний розлад; mGluR: метаботропний глутаматний рецептор; MHC: II Основний комплекс гістосумісності, клас 1; МРТ: магнітно-резонансна томографія; MRS: Магнітно-резонансна спектроскопія; NF-?B: ядерний фактор каппа B; NMDAR: N-метил-D-аспартатний рецептор; NRXNUMX: гліциновий сайт;
ОКР: обсесивно-компульсивний розлад; АБО: відношення шансів; PANDAS: дитячі нейропсихічні аутоімунні розлади, пов’язані зі стрептококовими інфекціями; PBMC: мононуклеарні клітини периферичної крові; ПЕТ: позитронно-емісійна томографія; PFC: префронтальна кора; PGE-2: простагландин E2; PPAR-
?: ядерний рецептор гамма, активований проліфератором пероксисом; QA: хінолінова кислота; RNS: активні форми азоту; АФК: активні форми кисню;
sIL: розчинний інтерлейкін; СКВ: системний червоний вовчак; SRI: інгібітор зворотного захоплення серотоніну; TNF-?: фактор некрозу пухлин альфа; T-regs: CD4+CD25 +FOXP3+ T-регуляторні клітини; TDO: Триптофан-2,3-діоксигеназа; Th: Т-хелпер; VGKC: вольтажний калієвий канал; XAG-: транспортер глутамат аспартату; Xc-: натрій-незалежний астрогліальний глутамат/цистин
система антипортер
Конкуруючі інтереси
Автори заявляють, що вони не мають конкуруючих інтересів.
Авторські внески
SN і DMP провели великий огляд літератури, інтерпретували дані, підготували рукопис, малюнки та таблиці. К. А. підготував розділ, що стосується окислювальних механізмів, і зробив внесок у редагування рукопису. AN і OD критично переглянули та покращили дизайн та якість рукопису. Усі автори прочитали та затвердили остаточний рукопис.
Подяки
Ми висловлюємо вдячність Dr. Джозеп Далмау, доктор медичних наук, доктор медичних наук, Трейсі Батлер, доктор медичних наук, і Девід Зазаг, доктор медичних наук, доктор філософії, за надання їхнього досвіду в області аутоімунних енцефалітів, візуалізації нейрозапалення та нейропатології відповідно.
Подробиці про автора
1 Кафедра неврології, Школа медицини Нью-Йоркського університету, 550 First Avenue, Нью-Йорк, NY 10016, США. 2 Медична школа Гейзеля в Дартмуті, Дартмутський інститут політики охорони здоров'я та клінічної практики, 30 Lafayette Street, HB 7252, Ліван, NH 03766, США. 3 Відділення патології, Відділення нейропатології, Школа медицини Нью-Йоркського університету, 550 First Avenue, Нью-Йорк, NY 10016, США. 4 Кафедра психіатрії, Школа медицини Нью-Йоркського університету, Нью-Йорк, Нью-Йорк, США. 5 Комплексний центр епілепсії Нью-Йоркського університету, 550 First Avenue, Нью-Йорк, NY 10016, США.
Бланк
Список використаної літератури:
1. Kayser MS, Dalmau J: Виникаючий зв'язок між аутоімунними розладами
і нервово-психічні захворювання. J Neuropsychiatry Clin Neurosci 2011, 23:90�97.
2. Najjar S, Pearlman D, Zagzag D, Golfinos J, Devinsky O: Глутамінова кислота
синдром декарбоксилазних аутоантитіл, що проявляється як шизофренія.
Невролог 2012, 18:88�91.
3. Граус Ф., Саїз А., Далмау Дж.: Антитіла та аутоімунні нейрони
розлади ЦНС. J Neurol 2010, 257:509 517.
4. Lennox BR, Coles AJ, Vincent A: Антитіла-опосередкований енцефаліт: a
причина шизофренії, що піддається лікуванню. Br J Psychiatry 2012, 200:92�94.
5. Zandi MS, Irani SR, Lang B, Waters P, Jones PB, McKenna P, Coles AJ, Вінсент
A, Lennox BR: Релевантні захворювання аутоантитіла в першому епізоді
шизофренія. J Neurol 2011, 258:686�688.
6. Bataller L, Kleopa KA, Wu GF, Rossi JE, Rosenfeld MR, Dalmau J:
Аутоімунний лімбічний енцефаліт у 39 хворих: імунофенотипи та
результати. J Neurol Neurosurg Psychiatry 2007, 78:381-385.
7. Dale RC, Heyman I, Giovannoni G, Church AW: Частота антимозкових захворювань
антитіла у дітей з обсесивно-компульсивним розладом. Br J Психіатрія
2005, 187:314–319.
8. Кендлер К.С.: Неоднозначна природа причин психіатричних захворювань: заміна
дихотомія органічне-функціональне/апаратне-програмне забезпечення з емпірично
заснований плюралізм. Mol Psychiatry 2012, 17:377�388.
9. Кескін Г., Сантер Г., Міді І., Тунсер Н.: Нейросифіліс як причина когнітивних
зниження та психічні симптоми у молодшому віці. J Neuropsychiatry Clin
Neurosci 2011, 23:E41�E42.
10. Лебойєр М., Сорека І., Скотт Дж., Фрай М., Генрі С., Тамоза Р., Купфер Д.Ж.: Can
розглядати біполярний розлад як багатосистемне запальне захворювання?
J Affect Disord 2012, 141:1�10.
11. Hackett ML, Yapa C, Parag V, Anderson CS: Частота депресії після
інсульт: систематичний огляд обсерваційних досліджень. Інсульт 2005, 36:1330�1340.
12. Данцер Р., О'Коннор Дж.К., Фройнд Г.Г., Джонсон Р.В., Келлі К.В.: Від
запалення до хвороби і депресії: коли імунна система
підпорядковує собі мозок. Nat Rev Neurosci 2008, 9:46�56.
13. Laske C, Zank M, Klein R, Stransky E, Batra A, Buchkremer G, Schott K:
Реактивність аутоантитіл у сироватці крові пацієнтів із великою депресією,
шизофренія та здоровий контроль. Psychiatry Res 2008, 158:83�86.
14. Айзенбергер Н.І., Беркман Е.Т., Інагакі Т.К., Рамесон Л.Т., Машал Н.М., Ірвін М.Р.:
Ангедонія, спричинена запаленням: ендотоксин зменшує вентральний смугастий тіло
відповіді на винагороду. Біологічна психіатрія 2010, 68:748-754.
15. Haroon E, Raison CL, Miller AH: Психонейроімунологія зустрічається
нейропсихофармакологія: трансляційні наслідки впливу
запалення в поведінці. Нейропсихофармакологія 2012, 37:137�162.
16. Бенрос М.Е., Нільсен П.Р., Нордентофт М., Ітон В.В., Далтон С.О., Мортенсен П.Б.:
Аутоімунні захворювання та важкі інфекції як фактори ризику
шизофренія: 30-річне популяційне реєстрове дослідження. Am J Психіатрія
2011, 168:1303–1310.
17. McNally L, Bhagwagar Z, Hannestad J: Запалення, глутамат і глія
при депресії: огляд літератури. CNS Spectr 2008, 13:501�510.
18. Харрісон Н.А., Брайдон Л., Уокер С., Грей М.А., Стептоу А., Крічлі HD:
Запалення спричиняє зміни настрою через зміни підгену
мозкова активність і мезолімбічна зв’язність. Біологічна психіатрія 2009 р.,
66:407�414.19. Raison CL, Miller AH: Чи є депресія запальним розладом?
Curr Psychiatry Rep 2011, 13:467�475.
20. Raison CL, Miller AH: Еволюційне значення депресії в
Захист збудника (PATHOS-D). Mol Psychiatry 2013, 18:15�37.
21. Штайнер Дж., Богертс Б., Сарняї З., Вальтер М., Гос Т., Бернстайн Х.Г., Майнт А.М.:
Усунення розриву між імунною та глутаматною гіпотезами
шизофренія та велика депресія: Потенційна роль гліального NMDA
модулятори рецепторів і порушення цілісності гематоенцефалічного бар’єру. Світ Дж
Біологічна психіатрія 2012, 13:482�492.
22. Штайнер Дж., Маврін С., Зігелер А., Білау Х., Ульріх О., Бернштейн Х.Г., Богертс Б.:
Розподіл HLA-DR-позитивної мікроглії при шизофренії відображає
порушення латералізації мозку. Acta Neuropathol 2006, 112:305-316.
23. Папакостас Г.І., Шелтон Р.К., Кінріс Г., Генрі М.Є., Баков Б.Р., Ліпкін Ш.Х., Пі Б.,
Thurmond L, Bilello JA: Оцінка багаторазового аналізу на основі сироватки
біологічний діагностичний тест великого депресивного розладу: пілот і
дослідження реплікації. Mol Psychiatry 2013, 18:332�339.
24. Крішнан Р. Уніполярна депресія у дорослих: епідеміологія, патогенез та
нейробіології. В UpToDate. За редакцією Басов Д.С. Waltham, MA: UpToDate; 2013 рік.
25. Стовалл Дж. Біполярний розлад у дорослих: епідеміологія та діагностика. в
UpToDate. За редакцією Басов Д.С. UpToDate: Waltham; 2013 рік.
26. Фішер Б.А., Бьюкенен Р.В.: Шизофренія: епідеміологія та патогенез.
В UpToDate. За редакцією Басов Д.С. Waltham, MA: UpToDate; 2013 рік.
27. Nestadt G, Samuels J, Riddle M, Bienvenu OJ 3rd, Liang KY, LaBuda M,
Walkup J, Grados M, Hoehn-Saric R: Сімейне дослідження обсесивно-компульсивного синдрому
розлад. Arch Gen Psychiatry 2000, 57:358�363.
28. Стефанссон Х., Оффофф Р.А., Стейнберг С., Андреассен О.А., Сіхон С., Руєску Д.
Werge T, Pietilainen OP, Mors O, Mortensen PB, Sigurdsson E, Gustafsson O,
Nyegaard M, Tuulio-Henriksson A, Ingason A, Hansen T, Suvisaari J,
Лоннквіст Дж., Пауніо Т., Берглум А.Д., Хартманн А., Фінк-Йенсен А., Нордентофт
M, Hougaard D, Norgaard-Pedersen B, Büttcher Y, Olesen J, Breuer R, Müller
HJ, Giegling I, et al: Загальні варіанти, що надають ризик шизофренії.
Природа 2009, 460:744�747.
29. Мюллер Н., Шварц М.Дж.: імуноопосередкована зміна серотоніну та
глутамат: до комплексного погляду на депресію. Мол психіатрія
2007, 12:988–1000.
30. Galecki P, Florkowski A, Bienkiewics M, Szemraj J: Функціональний поліморфізм
гена циклооксигенази-2 (G-765C) у пацієнтів з депресією.
Нейропсихобіологія 2010, 62:116�120.
31. Левінсон Д.Ф.: Генетика депресії: огляд. Біологічна психіатрія 2006 р.,
60: 84�92.
32. Zhai J, Cheng L, Dong J, Shen Q, Zhang Q, Chen M, Gao L, Chen X, Wang K,
Ден X, Xu Z, Ji F, Liu C, Li J, Dong Q, Chen C: ген S100B
поліморфізми передбачають префронтальну просторову функцію в обох шизофренії
пацієнтів і здорових людей. Schizophr Res 2012, 134:89�94.
33. Zhai J, Zhang Q, Cheng L, Chen M, Wang K, Liu Y, Deng X, Chen X, Shen Q,
Xu Z, Ji F, Liu C, Dong Q, Chen C, Li J: варіанти ризику в гені S100B,
пов'язані з підвищеними рівнями S100B, також пов'язані з
порушення зору при шизофренії. Behav Brain Res 2011, 217:363�368.
34. Каппі С., Муніс РК, Сампайо А.С., Кордейро К., Брентані Х., Паласіос С.А.,
Маркес А.Х., Валлада Х., Мігель Є.К., Гільєрме Л., Хуні А.Г.: Асоціація
дослідження між функціональними поліморфізмами в гені TNF-альфа і
обсесивно-компульсивний розлад. Arq Neuropsiquiatr 2012, 70:87�90.
35. Мігель-Ідальго JJ, Baucom C, Dilley G, Overholser JC, Meltzer HY,
Stockmeier CA, Rajkowska G: Гліальний фібрилярний кислий білок
імунореактивність у префронтальної корі відрізняє молодші від
літні люди з великим депресивним розладом. Biol Psychiatry 2000, 48:861-873.
36. Altshuler LL, Abulseoud OA, Foland Ross L, Bartzokis G, Chang S, Mintz J,
Hellemann G, Vinters HV: зменшення астроцитів мигдалини у суб'єктів з
великий депресивний розлад, але не біполярний розлад. Біполярний розлад 2010 р.,
12: 541�549.
37. Вебстер М.Дж., Нейбл М.Б., Джонстон-Вілсон Н., Нагата К., Інагакі М., Йолкен Р.Х.:
Імуногістохімічна локалізація фосфорильованої гліальної фібрилярної кислоти
білок у префронтальній корі та гіпокампі у пацієнтів з
шизофренія, біполярний розлад і депресія. Brain Behav Immun 2001,
15: 388�400.
38. Doyle C, Deakin JFW: Менше астроцитів у лобовій корі при шизофренії,
депресія і біполярний розлад. Шизофренія Res 2002, 53:106.
39. Johnston-Wilson NL, Sims CD, Hofmann JP, Anderson L, Shore AD, Torrey
EF, Yolken RH: Специфічні для захворювання зміни білків лобової кори головного мозку
при шизофренії, біполярному розладі та великому депресивному розладі, The
Консорціум нейропатології Стенлі. Mol Psychiatry 2000, 5:142-149.
40. Gosselin RD, Gibney S, O'Malley D, Dinan TG, Cryan JF: Специфічні регіони
зниження імунореактивності гліального фібрилярного кислого білка в головному мозку
щуряча модель депресії. Neuroscience 2009, 159:915-925.
41. Банаср М., Думан Р.С.: Втрата глії в префронтальній корі достатня для
викликати депресивну поведінку. Біологічна психіатрія 2008, 64:863-870.
42. Коттер Д., Хадсон Л., Ландау С. Докази орбітофронтальної патології в
біполярний розлад і велика депресія, але не при шизофренії.
Біполярний розлад 2005 р., 7:358-369.
43. Браух Р.А., Аднан Ель-Масрі М., Паркер Дж.-молодший, Ель-Маллах Р.С.: Номер гліальної клітини
і співвідношення нейронів і гліальних клітин у посмертному мозку біполярних осіб.
J Affect Disord 2006, 91:87�90.
44. Cotter DR, Pariante CM, Everall IP: аномалії гліальних клітин у великих
Психічні розлади: докази та наслідки. Brain Res Bull 2001,
55: 585�595.
45. Cotter D, Mackay D, Landau S, Kerwin R, Everall I: Знижена щільність гліальних клітин
і розмір нейронів у передній поясній корі при великій депресії
розлад. Arch Gen Psychiatry 2001, 58:545�553.
46. Bowley MP, Drevets WC, Ong'r D, Price JL: Низькі гліальні числа в
мигдалина при великому депресивному розладі. Біологічна психіатрія 2002, 52:404�412.
47. Toro CT, Hallak JE, Dunham JS, Deakin JF: Гліальний фібрилярний кислий білок і
глутамінсинтетаза в субрегіонах префронтальної кори при шизофренії
і розлад настрою. Neurosci Lett 2006, 404:276�281.
48. Rajkowska G, Мігель-Ідальго JJ, Makkos Z, Meltzer H, Overholser J,
Stockmeier C: Специфічне зниження рівня GFAP-реактивної астроглії в
дорсолатеральна префронтальна кора при шизофренії. Schizophr Res 2002, 57:127-138.
49. Steffek AE, McCullumsmith RE, Haroutunian V, Meador-Woodruff JH: Cortical
Експресія гліального фібрилярного кислого білка і глутамінсинтетази є
зменшується при шизофренії. Schizophr Res 2008, 103:71�82.
50. Дамаджич Р., Бігелоу Л.Б., Кример Л.С., Голденсон Д.А., Сондерс Р.К., Клейнман
JE, Герман М.М.: Кількісне імуногістохімічне дослідження астроцитів в
енторинальної кори при шизофренії, біполярному розладі та мажорних
депресія: відсутність значного астроцитозу. Brain Res Bull 2001, 55:611-618.
51. Benes FM, McSparren J, Bird ED, SanGiovanni JP, Vincent SL: Дефіцити в
малі інтернейрони в префронтальній і поясній корі шизофренічних
та шизоафективних пацієнтів. Arch Gen Psychiatry 1991, 48:996-1001.
52. Мюллер Н., Шварц М.Дж.: Імунна система та шизофренія. Curr Immunol
Rev 2010, 6:213�220.
53. Штайнер Дж., Уолтер М., Гос Т., Гільємін Г.Дж., Бернштейн Х.Г., Сарняї З., Маврін С.
Brisch R, Bielau H, Meyer Zu Schwabedissen L, Bogerts B, Myint AM: Важка
депресія пов’язана зі збільшенням мікроглії хінолінової кислоти в
підобласті передньої поясної звивини: докази імуномодульованого
глутаматергічна нейротрансмісія? J Neuroinflammation 2011, 8:94.
54. Востріков В.М., Уранова Н.А., Орловська Д.Д.: Дефіцит перинейронального
олігодендроцити в префронтальній корі при шизофренії та настрої
розлади. Schizophr Res 2007, 94:273-280.
55. Rajkowska G, Miguel-Hidalgo JJ: Гліогенез і гліальна патологія в
депресія. Цілі ліків від нервових розладів ЦНС 2007, 6:219�233.
56. Уранова Н.А., Востріков В.М., Орловська Д.Д., Рахманова В.І.
Олігодендрогліальна щільність у префронтальній корі при шизофренії та
розлади настрою: дослідження Консорціуму нейропатології Стенлі.
Schizophr Res 2004, 67:269-275.
57. Уранова Н.: Пошкодження та втрата олігодендроцитів мають вирішальне значення в
Патогенез шизофренії та розлади настрою (висновки форми
посмертні дослідження). Нейропсихофармакологія 2004, 29:S33.
58. Уранова Н.А., Орловська Д.Д., Востріков В.М., Рахманова В.І.: Зменш.
щільність олігодендрогліальних супутників пірамідних нейронів у шарі III ст
префронтальна кора при шизофренії та розладах настрою. Schizophr Res
2002, 53: 107.
59. Востріков В.М., Уранова Н.А., Рахманова В.І., Орловська Д.Д.: Зниж.
Щільність олігодендрогліальних клітин у префронтальній корі при шизофренії.
Ж Неврол Психіатр ім С. С. Корсакова 2004, 104:47�51.
60. Уранова Н.А., Зіміна І.С., Віхрєва О.В., Круков Н.О., Рахманова В.І., Орловська.
DD: Ультраструктурне пошкодження капілярів у неокортексі в
шизофренія. World J Biol Psychiatry 2010, 11:567�578.
61. Hof PR, Haroutunian V, Friedrich VL Jr, Byne W, Buitron C, Perl DP, Davis KL:
Втрата і змінений просторовий розподіл олігодендроцитів у верхній частині
лобова звивина при шизофренії. Biol Psychiatry 2003, 53:1075-1085.
62. Девіс К.Л., Стюарт Д.Г., Фрідман Дж.І., Буксбаум М., Харві П.Д., Хоф П.Р.,
Буксбаум Дж., Арутюніан В. Зміни білої речовини при шизофренії:
докази дисфункції, пов’язаної з мієліном. Arch Gen Psychiatry 2003,
60:443�456.63. Flynn SW, Lang DJ, Mackay AL, Goghari V, Vavasour IM, Whittall KP, Smith
GN, Arango V, Mann JJ, Dwork AJ, Falkai P, Honer WG: Аномалії
мієлінізація при шизофренії виявляється in vivo за допомогою МРТ і посмертно
з аналізом білків олігодендроцитів. Mol Psychiatry 2003,
8: 811�820.
64. Уранова Н.А., Востріков В.М., Віхрєва О.В., Зіміна І.С., Коломєєць Н.С., Орловська.
ДД: Роль патології олігодендроцитів у шизофренії. Інт Дж
Neuropsychopharmacol 2007, 10:537-545.
65. Byne W, Kidkardnee S, Tatusov A, Yannoulos G, Buchsbaum MS,
Арутюніан V: асоційоване із шизофренією зменшення нейронального і
кількість олігодендроцитів у передньому головному ядрі таламуса.
Schizophr Res 2006, 85:245-253.
66. Hamidi M, Drevets WC, Price JL: Glial Reducting in amygdala in major
депресивний розлад зумовлений олігодендроцитами. Біологічна психіатрія 2004 р.,
55: 563�569.
67. Байєр Т.А., Буслей Р., Хавас Л., Фалкай П.: Докази активації мікроглії в
пацієнти з психічними захворюваннями. Neurosci Lett 1999, 271:126-128.
68. Штайнер Дж., Білау Х., Бріш Р., Данос П., Ульріх О., Маврін К., Бернстайн Х.Г.
Богерц Б.: Імунологічні аспекти в нейробіології суїциду:
підвищена щільність мікроглії при шизофренії та депресії
пов'язаний із самогубством. J Psychiatr Res 2008, 42:151�157.
69. Rao JS, Harry GJ, Rapoport SI, Kim HW: Підвищена ексайтотоксичність і
нейрозапальні маркери в посмертній лобній корі від біполярного
пацієнтів з розладами. Mol Psychiatry 2010, 15:384�392.
70. Bernstein HG, Steiner J, Bogerts B: Гліальні клітини при шизофренії:
патофізіологічне значення та можливі наслідки для терапії.
Expert Rev Neurother 2009, 9:1059–1071.
71. Чен С.К., Тврдік П., Педен Е., Чо С., Ву С., Спангруде Г., Капекчі М.Р.:
Гематопоетичне походження патологічного догляду у мутантних мишей Hoxb8.
Клітинка 2010, 141:775�785.
72. Антоній Дж. М.: Догляд і вирощування за допомогою мікроглії. Sci Signal 2010, 3:jc8.
73. Воноді І, Стайн О.С., Сатьясаікумар К.В., Робертс Р.К., Мітчелл Б.Д., Хонг Л.Є.,
Kajii Y, Thaker GK, Schwarcz R: Знижене регулювання кінуреніну 3-
Експресія гена монооксигенази та активність ферменту при шизофренії
і генетична асоціація з ендофенотипами шизофренії. Арка Ген
Психіатрія 2011, 68:665�674.
74. Raison CL, Lowry CA, Rook GA: Запалення, санітарія та
страх: втрата контакту з коеволюціонуючими, толерогенними
мікроорганізмів та патофізіології та лікування мажор
депресія. Arch Gen Psychiatry 2010, 67:1211�1224.
75. Drexhage RC, Hoogenboezem TH, Versnel MA, Berghout A, Nolen WA,
Drexhage HA: активація мереж моноцитів і Т-клітин у пацієнтів
з біполярним розладом. Brain Behav Immun 2011, 25:1206�1213.
76. Штайнер Дж., Джейкобс Р., Пантелі Б., Браунер М., Шильц К., Бан С., Герберт М.
Вестфал С., Гос Т., Уолтер М., Бернстайн Х.Г., М’їнт А.М., Богертс Б.: Гострий
шизофренія супроводжується зниженням Т-клітин і збільшенням В-клітин
імунітет. Eur Arch Psychiatry Clin Neurosci 2010, 260:509�518.
77. Rotge JY, Aouizerate B, Tignol J, Bioulac B, Burbaud P, Guehl D: The
генетична імунна гіпотеза на основі глутамату при обсесивно-компульсивних станах
розлад, інтегративний підхід від генів до симптомів.
Neuroscience 2010, 165:408�417.
78. Y�ksel C, Ong�r D: Дослідження магнітно-резонансної спектроскопії
аномалії, пов’язані з глутаматом, при розладах настрою. Біологічна психіатрія 2010,
68: 785�794.
79. Rao JS, Kellom M, Reese EA, Rapoport SI, Kim HW: Порушена регуляція глутамату
і транспортери дофаміну в посмертній лобній корі від біполярного
та хворих на шизофренію. J Affect Disord 2012, 136:63�71.
80. Бауер Д., Гупта Д., Аротуніан В., Меадор-Вудрафф Дж.Х., МакКалумсміт Р.Є.
Аномальна експресія транспортера та транспортера глутамату
взаємодіючі молекули префронтальної кори у пацієнтів літнього віку з
шизофренія. Schizophr Res 2008, 104:108�120.
81. Matute C, Melone M, Vallejo-Illarramendi A, Conti F: Посилене вираження
транспортера астроцитарного глутамату GLT-1 в префронтальній корі
шизофренії. 2005, 49:451�455.
82. Сміт RE, Haroutunian V, Davis KL, Meador-Woodruff JH: Expression of
транскрипти збудливого транспортера амінокислот у таламусі суб'єктів
з шизофренією. Am J Psychiatry 2001, 158:1393-1399.
83. McCullumsmith RE, Meador-Woodruff JH: збудлива амінокислота смугастої оболонки
експресія транскрипту транспортера при шизофренії, біполярному розладі,
і великий депресивний розлад. Нейропсихофармакологія 2002 р.,
26: 368�375.
84. Pittenger C, Bloch MH, Williams K: Глутаматні аномалії в обсесивних
компульсивний розлад: нейробіологія, патофізіологія та лікування.
Pharmacol Ther 2011, 132:314-332.
85. Хашимото К.: Нова роль глутамату в патофізіології
великий депресивний розлад. Brain Res Rev 2009, 61:105�123.
86. Хашимото К., Сава А., Ійо М.: Підвищений рівень глутамату в мозку від
пацієнти з розладами настрою. Біологічна психіатрія 2007, 62:1310-1316.
87. Бурбаєва Г., Бокша І.С., Турищева М.С., Воробйова Є.А., Савушкіна О.К.,
Терешкіна Є. Б.: Глютамінсинтетаза і глутаматдегідрогеназа в
префронтальна кора у хворих на шизофренію. Prog
Neuropsychopharmacol Biol Psychiatry 2003, 27:675-680.
88. Бхаттачарія С, Кханна С, Чакрабарті К, Махадеван А, Крістофер Р,
Шанкар С.К.: Аутоантитіла до головного мозку та змінені збудливі
нейромедіатори при обсесивно-компульсивному розладі.
Нейропсихофармакологія 2009, 34:2489�2496.
89. Санакора Г., Георгієва Р., Епперсон Ч.Н., Ву Ю.Т., Аппель М., Ротман Д.Л.,
Кристал Дж.Х., Мейсон Г.Ф.: Підтипові зміни гаммааміномасляної кислоти
кислота і глутамат у пацієнтів з великою депресією.
Arch Gen Psychiatry 2004, 61:705-713.
90. Марсман А., депутат ван ден Хейвел, Кломп Д.В., Кан Р.С., Луйтен П.Р., Хулсхофф
Pol HE: Глутамат при шизофренії: цілеспрямований огляд і мета-аналіз
досліджень 1H-MRS. Schizophr Bull 2013, 39:120�129.
91. Liu Y, Ho RC, Mak A: Інтерлейкін (IL)-6, фактор некрозу пухлин альфа
(TNF-альфа) і розчинні рецептори інтерлейкіну-2 (sIL-2R) підвищені в
Пацієнти з великим депресивним розладом: мета-аналіз і метарегресія.
J Affect Disord 2012, 139:230�239.
92. Brietzke E, Stabellini R, Grassis-Oliveira R, Lafer B: Цитокіни в біполярних
розлад: останні висновки, шкідливі наслідки, але обіцяють майбутнє
терапевтичні засоби. CNS Spectr 2011. www.cnsspectrums.com/aspx/
articledetail.aspx?articleid=3596.
93. Деніс Д., Флайтман С., Кавелаарс А., Хейнен С., Вестенберг Х.: Зменшено
Активність TNF-альфа і NK при обсесивно-компульсивному розладі.
Психонейроендокринологія 2004, 29:945-952.
94. Брамбілла Ф., Перна Г., Беллоді Л., Арансіо К., Бертані А., Періні Г., Карраро К., Гава
F: концентрації інтерлейкіну-1 бета в плазмі та фактора некрозу пухлини
обсесивно-компульсивні розлади. Biol Psychiatry 1997, 42:976-981.
95. Флюйтман С, Денис Д, Вулінк Н, Шуттерс С, Хейнен С, Вестенберг Х:
Ліпополісахарид-індукована продукція цитокінів при обсесивно-компульсивному стані
розлад і генералізований соціальний тривожний розлад. Психіатрія
Res 2010, 178:313.
96. Джанелідзе S, Mattei D, Westrin A, Traskman-Bendz L, Brundin L: Цитокін
рівень у крові може відрізнити спроби суїциду від депресії
пацієнтів. Brain Behav Immun 2011, 25:335�339.
97. Postal M, Costallat LT, Appenzeller S: нейропсихіатричні прояви в
системний червоний вовчак: епідеміологія, патофізіологія та
управління. Препарати ЦНС 2011, 25:721-736.
98. Козора Є., Ханлі Ю.Г., Лаптєва Л., Філлі К.М.: Когнітивна дисфункція в
системний червоний вовчак: минуле, теперішнє та майбутнє.
Артрит Rheum 2008, 58:3286-3298.
99. Ланкастер Е., Мартінес-Ернандес Е., Далмау Дж.: Енцефаліт та антитіла до
синаптичні та нейрональні білки клітинної поверхні. Неврологія 2011, 77:179�189.
100. Dalmau J, Lancaster E, Martinez-Hernandez E, Rosenfeld MR, Balice-Gordon
R: Клінічний досвід та лабораторні дослідження у пацієнтів з антиNMDAR
енцефаліт. Lancet Neurol 2011, 10:63�74.
101. Лай М., Хьюйберс М.Г., Ланкастер Е., Граус Ф., Баталлер Л., Баліс-Гордон Р., Коуелл
JK, Dalmau J: Дослідження LGI1 як антигену при лімбічному енцефаліті
раніше віднесені до калієвих каналів: серія випадків. Lancet Neurol
2010, 9:776–785.
102. Lancaster E, Huijbers MG, Bar V, Boronat A, Wong A, Martinez-Ернандес E,
Вілсон С., Джейкобс Д., Лай М., Уокер Р.В., Граус Ф., Баталлер Л., Ілла І., Марккс С., Штраус
KA, Peles E, Scherer SS, Dalmau J: Дослідження caspr2, аутоантигену
енцефаліт і нейроміотонія. Енн Нейрол 2011, 69:303�311.
103. Ланкастер Е, Лай М, Пенг Х, Хьюз Е, Константінеску Р, Райзер Дж, Фрідман
D, Skeen MB, Grisold W, Kimura A, Ohta K, Iizuka T, Guzman M, Graus F,
Moss SJ, Balice-Gordon R, Dalmau J: Антитіла до рецептора GABA(B) у
Лімбічний енцефаліт з судомами: ряд випадків і характеристика
антиген. Lancet Neurol 2010, 9:67�76.
104. Ланкастер Е., Мартінес-Ернандес Е., Тітулаер М.Дж., Булос М., Уівер С., Антуан
JC, Liebers E, Kornblum C, Bien CG, Honnorat J, Wong S, Xu J, Підрядник A,
Баліс-Гордон Р., Далмау Дж.: Антитіла до метаботропного глутамату
рецептор 5 при синдромі Офелії. Неврологія 2011, 77:1698�1701.105. Ances BM, Vitaliani R, Taylor RA, Liebeskind DS, Voloschin A, Houghton DJ,
Galetta SL, Dichter M, Alavi A, Rosenfeld MR, Dalmau J: Лікування
лімбічний енцефаліт, ідентифікований за антитілами нейропіла: МРТ і
PET корелює. Брейн 2005, 128:1764�1777.
106. Тофаріс Г.К., Ірані С.Р., Чіран Б.Дж., Бейкер І.В., Кадер З.М., Вінсент А.:
Хорея, що реагує на імунотерапію, як ознака LGI1-
антитіл енцефаліт. Неврологія 2012, 79:195�196.
107. Найджар С., Перлман Д., Наджар А., Гіасіан В., Загзаг Д., Девінскі О.:
Екстралімбічний аутоімунний енцефаліт, пов’язаний з глутаміновою кислотою
Антитіла до декарбоксилази: недостатньо діагностована особа? Поведінка при епілепсії
2011, 21:306–313.
108. Тітулаер М.Дж., МакКракен Л., Габілондо І., Армангу Т., Глейзер К., Іізука Т., Хоніг
Л.С., Бенселер С.М., Кавачі І., Мартінес-Ернандес Е., Агілар Е., Греса-Аррібас Н.,
Райан-Флоранс Н., Торрентс А., Саїз А., Розенфельд М.Р., Баліс-Гордон Р., Граус Ф.,
Далмау Дж.: Лікування та прогностичні фактори для довгострокового результату в
пацієнти з анти-NMDA-рецепторним енцефалітом: когорта спостереження
вивчення. Lancet Neurol 2013, 12:157�165.
109. Dalmau J, Gleichman AJ, Hughes EG, Rossi JE, Peng X, Lai M, Dessain SK,
Розенфельд MR, Balice-Gordon R, Lynch DR: Анти-NMDA-рецептор
енцефаліт: ряд випадків та аналіз дії антитіл.
Lancet Neurol 2008, 7:1091–1098.
110. Граус Ф, Боронат А, Ксіфро Х, Буа М, Свігель В, Гарсія А, Паломіно А, Сабатер
L, Alberch J, Saiz A: Розширення клінічного профілю анти-АМРА-рецептора
енцефаліт. Неврологія 2010, 74:857�859.
111. Lai M, Hughes EG, Peng X, Zhou L, Gleichman AJ, Shu H, Mata S, Kremens
Д., Віталіані Р., доктор медичних наук Гешвінд, Л. Баталлер, Калб Р.Г., Девіс Р., Граус Ф., Лінч Д.Р.,
Р. Баліс-Гордон, Дж. Далмау: Антитіла до рецептора АМРА в лімбіці
енцефаліт змінює розташування синаптичних рецепторів. Енн Нейрол 2009, 65:424�434.
112. Найджар С., Перлман Д., Девінскі О., Найджар А., Надкарні С., Батлер Т., Загзаг Д.:
нейропсихічний аутоімунний енцефаліт з негативним VGKC-комплексом,
Аутоантитіла NMDAR та GAD: звіт про випадок та огляд літератури,
майбутній. Cogn Behav Neurol. в пресі.
113. Najjar S, Pearlman D, Zagzag D, Devinsky O: спонтанне вирішення
серонегативний аутоімунний лімбічний енцефаліт. Cogn Behav Neurol 2011,
24: 99�105.
114. Габілондо І, Саїз А, Галан Л, Гонсалес В, Хадраке Р, Сабатер Л, Санс А,
Sempere A, Vela A, Villalobos F, Vials M, Villoslada P, Graus F: Аналіз
рецидиви анти-NMDAR енцефаліту. Неврологія 2011, 77: 996-999.
115. Баррі Х., Хардіман О., Хілі Д.Г., Кеоган М., Мороні Дж., Молнар П.П., Коттер
DR, Murphy KC: Анти-NMDA-рецепторний енцефаліт: важливо
диференційна діагностика при психозах. Br J Psychiatry 2011, 199:508�509.
116. Дікерсон Ф., Столлінгс К., Воган К., Орігоні А., Хушалані С., Йолкен Р.:
Антитіла до глутаматного рецептора при манії. Біполярний розлад 2012 р.,
14: 547�553.
117. O'Loughlin K, Ruge P, McCauley M: Енцефаліт та шизофренія: a
справа слів. Br J Psychiatry 2012, 201:74.
118. Парратт К. Л., Аллан М., Льюїс С. Дж., Далмау Дж., Халмаджі Г. М., Спис Дж. М.: Гостра
психіатричні захворювання у молодої жінки: незвичайна форма енцефаліту.
Med J Aust 2009, 191:284�286.
119. Судзукі Ю., Куріта Т., Сакурай К., Такеда Ю., Кояма Т.: Звіт про випадки анти-NMDA
рецепторний енцефаліт з підозрою на шизофренію. Сейшин Сінкейгаку
Засші 2009, 111:1479�1484.
120. Цуцуй К, Канбаяші Т, Танака К, Боку С, Іто В, Токунага Дж, Морі А,
Хісікава Y, Shimizu T, Nishino S: виявлено антитіла до NMDA-рецептора
при енцефаліті, шизофренії та нарколепсії з психотичними ознаками.
BMC Psychiatry 2012, 12:37.
121. Ван Путтен В.К., Хачімі-Ідріссі С., Янсен А., Ван Горп В., Гюйгенс Л.:
Нечаста причина психотичної поведінки у 9-річної дівчинки: випадок
звіт. Звіт про справу Med 2012, 2012:358520.
122. Масдеу Ж.К., Гонсалес-Пінто А., Матуте С., Руїс Де Азуа С., Паломіно А., Де
Леон Дж., Берман К.Ф., Далмау Дж.: сироваткові антитіла IgG проти NR1
субодиниця рецептора NMDA не виявлена при шизофренії. Ам Дж
Психіатрія 2012, 169:1120�1121.
123. Кірван CA, Swedo SE, Kurahara D, Cunningham MW: мімікрія стрептококів
і антитіло-опосередкована клітинна передача сигналів у патогенезі
хорея Сіденхема. Аутоімунітет 2006, 39:21�29.
124. Swedo SE: стрептококова інфекція, синдром Туретта та OCD: чи є
зв'язок? Панди: Кінь чи зебра? Неврологія 2010, 74:1397�1398.
125. Морер А., Лазаро Л., Сабатер Л., Массана Дж., Кастро Дж., Граус Ф.: Антинейрональні
антитіла в групі дітей з обсесивно-компульсивним розладом
і синдром Туретта. J Psychiatr Res 2008, 42:64�68.
126. Pavone P, Bianchini R, Parano E, Incorpora G, Rizzo R, Mazzone L, Trifiletti RR:
Антитіла до мозку в PANDAS проти неускладнених стрептококових антитіл
інфекції. Pediatr Neurol 2004, 30:107-110.
127. Майна Г., Альберт У., Богетто Ф., Боргезе К., Берро А.Ч., Мутані Р., Россі Ф.
Vigliani MC: Антитіла до мозку у дорослих пацієнтів з обсесивно-компульсивним синдромом
розлад. J Affect Disord 2009, 116:192�200.
128. Брімберг Л., Бенхар І., Маскаро-Бланко А., Альварес К., Лотан Д., Вінтер С., Кляйн Дж.
Мозес А.Е., Сомньєр Ф.Е., Лекман Дж.Ф., Свідо С.Е., Каннінгем М.В., Джоел Д.:
Поведінкові, фармакологічні та імунологічні відхилення після
Вплив стрептококу: нова модель хореї Сіденхема та щурів
супутні нервово-психічні розлади. Нейропсихофармакологія 2012 р.,
37: 2076�2087.
129. Dale RC, Candler PM, Church AJ, Wait R, Pocock JM, Giovannoni G:
Поверхневі гліколітичні ферменти нейронів є мішенями для аутоантигенів
постстрептококове аутоімунне захворювання ЦНС. J Neuroimmunol 2006,
172: 187�197.
130. Ніколсон TR, Фердинандо S, Krishnaiah RB, Anhoury S, Lennox BR, Mataix Cols
D, Cleare A, Veale DM, Drummond LM, Fineberg NA, Church AJ,
Джованні Г., Хейман І. Поширеність антитіл проти базальних гангліїв у
Обсесивно-компульсивний розлад дорослих: поперечне дослідження. Br J Психіатрія
2012, 200:381–386.
131. Ву К., Ханна Г.Л., Розенберг Д.Р., Арнольд П.Д.: роль глутамату
сигналізації в патогенезі та лікуванні обсесивно-компульсивних станів
розлад. Pharmacol Biochem Behav 2012, 100:726�735.
132. Перлмуттер С.Дж., Лейтман С.Ф., Гарві М.А., Гамбургер С., Фельдман Е., Леонард
HL, Swedo SE: Терапевтичний плазмообмін і внутрішньовенний
імуноглобулін при обсесивно-компульсивних розладах і тиках в
дитинство. Lancet 1999, 354:1153�1158.
133. Pereira A Jr, Furlan FA: Астроцити та людське пізнання: моделювання
інтеграція інформації та модуляція активності нейронів.
Prog Neurobiol 2010, 92:405-420.
134. Баррес Б.А.: Таємниця і магія глії: погляд на їхні ролі в
здоров'я і хвороби. Neuron 2008, 60:430�440.
135. Верхратський А., Парпура В., Родрігес Дж. Дж.: Де живуть думки:
фізіологія нейронно-гліальної «дифузної нейронної мережі». Brain Res Rev 2011,
66: 133�151.
136. Софронєв М.В.: Молекулярне розшарування реактивного астрогліозу та гліального рубця
формування. Trends Neurosci 2009, 32:638�647.
137. Hamilton NB, Attwell D: Чи справді астроцити екзоцитозують нейромедіатори?
Nat Rev Neurosci 2010, 11:227�238.
138. Rajkowska G: Посмертні дослідження розладів настрою вказують на зміни
кількість нейронів і гліальних клітин. Biol Psychiatry 2000, 48:766-777.
139. Coupland NJ, Ogilvie CJ, Hegadoren KM, Seres P, Hanstock CC, Allen PS:
Зниження префронтального міоінозитолу при великому депресивному розладі.
Біологічна психіатрія 2005, 57:1526�1534.
140. Мігель-Ідальго JJ, Overholser JC, Jurjus GJ, Meltzer HY, Dieter L, Konick L,
Stockmeier CA, Rajkowska G: Судинна та позасудинна імунореактивність
для молекули міжклітинної адгезії 1 в орбітофронтальної корі
суб'єкти з великою депресією: вікові зміни. J Affect Disord
2011, 132:422–431.
141. Мігель-Ідальго JJ, Wei JR, Andrew M, Overholser JC, Jurjus G, Stockmeier
CA, Rajkowska G: Патологія глії в префронтальній корі в алкоголі
залежність із симптомами депресії та без них. Біологічна психіатрія 2002 р.,
52: 1121�1133.
142. Stockmeier CA, Mahajan GJ, Konick LC, Overholser JC, Jurjus GJ, Meltzer HY,
Uylings HB, Friedman L, Rajkowska G: Клітинні зміни в посмертному житті
гіпокамп при великій депресії. Біологічна психіатрія 2004, 56:640-650.
143. Онґер Д., Древець В.Ц., Прайс Дж.Л.
кори при розладах настрою. Proc Natl Acad Sci США 1998, 95:13290�13295.
144. Gittins RA, Harrison PJ: Морфометричне дослідження глії та нейронів у
передня поясна кора при розладі настрою. J Affect Disord 2011,
133: 328�332.
145. Cotter D, Mackay D, Beasley C, Kerwin R, Everall I: Знижена гліальна щільність
і об’єм нейронів при великому депресивному розладі та шизофренії в
передня поясна кора [реферат]. Шизофренія Res 2000, 41:106.
146. Si X, Мігель-Ідальго JJ, Rajkowska G: експресія GFAP зменшується в
дорсолатеральна префронтальна кора при депресії. У Товаристві нейронаук; 2003 рік.
План зустрічі з нейронауки: Новий Орлеан; 2003 рік.
147. Legutko B, Mahajan G, Stockmeier CA, Rajkowska G: Астроцити білої речовини
зменшуються при депресії. У Товаристві нейронаук. Зустріч з нейронаук
Планувальник: Вашингтон, округ Колумбія; 2011.148. Едгар Н, Сібілл Е: Передбачувана функціональна роль олігодендроцитів в
регуляція настрою. Transl Psychiatry 2012, 2:e109.
149. Rajkowska G, Halaris A, Selemon LD: Reduction in neuronal and glial
щільність характеризують дорсолатеральну префронтальну кору при біполярному
розлад. Biol Psychiatry 2001, 49:741-752.
150. Коттер Д., Маккей Д., Чана Г., Бізлі К., Ландау С., Еверолл IP: зменшено
розмір нейронів і щільність гліальних клітин у ділянці 9 дорсолатеральної
префронтальна кора у суб'єктів з великим депресивним розладом. Кора головного мозку
2002, 12:386–394.
151. Stark AK, Uylings HB, Sanz-Arigita E, Pakkenberg B: Втрата гліальних клітин у
передня поясна кора, субобласть префронтальної кори, в
суб'єкти з шизофренією. Am J Psychiatry 2004, 161:882-888.
152. Конопаске Г.Т., Дорф-Петерсен К.А., Світ Р.А., П’єррі Дж.Н., Чжан В., Семпсон
AR, Льюїс Д.А.: Вплив хронічного впливу антипсихотичних засобів на астроцит і
Кількість олігодендроцитів у мавп макак. Біологічна психіатрія 2008 р.,
63: 759�765.
153. Селемон Л.Д., Лідов М.С., Голдман-Ракіч П.С.: Збільшений об’єм і гліальний
щільність префронтальної кори приматів, пов'язана з хронічним
вплив антипсихотичних препаратів. Біологічна психіатрія 1999, 46:161-172.
154. Steiner J, Bernstein HG, Bielau H, Farkas N, Winter J, Dobrowolny H, Brisch R,
Gos T, Mawrin C, Myint AM, Bogerts B: S100B-імунопозитивна глія є
підвищений при параноїдах порівняно із залишковою шизофренією: a
морфометричне дослідження. J Psychiatr Res 2008, 42:868-876.
155. Carter CJ: eIF2B і виживання олігодендроцитів: де природа і виховання
зустрічаються при біполярному розладі та шизофренії? Шизофр Булл 2007 р.,
33: 1343�1353.
156. Хаяші Ю, Ніхонмацу-Кікучі Н, Хісанага С, Ю XJ, Татебаяші Ю:
Невропатологічні подібності та відмінності шизофренії
і біполярний розлад: посмертне дослідження мозку проточною цитометрією.
PLoS One 2012, 7:e33019.
157. Уранова Н.А., Віхрєва О.В., Рахманова В.І., Орловська Д.Д.: Ультраструктурна
зміни мієлінових волокон і олігодендроцитів у префронтальної області
кора при шизофренії: посмертне морфометричне дослідження.
Schizophr Res Treatment 2011, 2011: 325789.
158. Торрес-Платас С.Г., Хершер К., Даволі М.А., Мауссьон Г., Лабонте Б., Турецкі
G, Mechawar N: Астроцитарна гіпертрофія в передній поясній поясі білого кольору
питання депресивних самогубств. Нейропсихофармакологія 2011,
36: 2650�2658.
159. Pereira A Jr, Furlan FA: Про роль синхронізації для нейрона-астроцита
взаємодії та перцептивної свідомої обробки. J Biol Phys 2009,
35: 465�480.
160. Kettenmann H, Hanisch UK, Noda M, Verkhratsky A: Physiology of
мікроглія. Physiol Rev 2011, 91:461�553.
161. Трембле М.Є., Стівенс Б., Сьєрра А., Вейк Х., Бессіс А., Німмерджан А.: Роль
мікроглії в здоровому мозку. J Neurosci 2011, 31:16064�16069.
162. Кайндл А.М., Дего В., Пейно С., Гуадон Е., Чхор В., Лорон Г., Ле
Шарпентьє Т., Джоссеран Дж., Алі С., Вів’єн Д., Коллінгрідж Г.Л., Ломбет А., Ісса Л.,
Rene F, Loeffler JP, Kavelaars A, Verney C, Mantz J, Gressens P: Активація
мікрогліальні N-метил-D-аспартатні рецептори викликає запалення і
загибель нейронних клітин у мозку, що розвивається та зрілої. Енн Нейрол
2012, 72:536–549.
163. Шварц М, Шейк І, Фішер Дж, Мізрахі Т, Шорі Х: Захисний
аутоімунітет проти внутрішнього ворога: боротьба з токсичністю глутамату.
Trends Neurosci 2003, 26:297�302.
164. Pacheco R, Gallart T, Lluis C, Franco R: Роль глутамату на Т-клітини
опосередкований імунітет. J Neuroimmunol 2007, 185:9-19.
165. Najjar S, Pearlman D, Miller DC, Devinsky O: Рефрактерна епілепсія, асоційована
з активацією мікроглії. Невролог 2011, 17:249�254.
166. Schwartz M, Butovsky O, Bruck W, Hanisch UK: фенотип мікроглії: це
зобов'язання оборотні? Trends Neurosci 2006, 29:68�74.
167. Wang F, Wu H, Xu S, Guo X, Yang J, Shen X: міграція макрофагів
гальмівний фактор активує циклооксигеназу 2-простагландин Е2 в культурі
мікроглія хребта. Neurosci Res 2011, 71:210�218.
168. Zhang XY, Xiu MH, Song C, Chenda C, Wu GY, Haile CN, Kosten TA, Kosten
TR: Підвищений рівень S100B у сироватці крові у тих, хто ніколи не приймав ліки, і у ліків
хворі на шизофренію. J Psychiatr Res 2010, 44:1236�1240.
169. Kawasaki Y, Zhang L, Cheng JK, Ji RR: Цитокінові механізми центральної
сенсибілізація: чітка та перекривається роль інтерлейкіну-1бета,
інтерлейкін-6 і фактор некрозу пухлини-альфа в регуляції синаптичних і
активність нейронів у поверхневому спинному мозку. J Neurosci 2008,
28: 5189�5194.
170. Мюллер Н., Шварц М.Д.: Імунологічні основи глутаматергічної
порушення при шизофренії: у бік комплексного погляду. J Neural
Transm Suppl 2007, 72:269-280.
171. Hestad KA, Tonseth S, Stoen CD, Ueland T, Aukrust P: Підвищений рівень у плазмі
Фактора некрозу пухлин альфа у пацієнтів з депресією: нормалізація
під час електросудомної терапії. J ECT 2003, 19:183-188.
172. Кубера М, Кеніс Г, Босманс Е, Зієба А, Дудек Д, Новак Г, Мейс М:
Рівні рецепторів інтерлейкіну-6, інтерлейкіну-10 та інтерлейкіну-1 у плазмі
антагоніст при депресії: порівняння між гострим станом і після
ремісія. Pol J Pharmacol 2000, 52:237-241.
173. Miller BJ, Buckley P, Seabolt W, Mellor A, Kirkpatrick B: Мета-аналіз
Зміни цитокінів при шизофренії: клінічний статус та антипсихотичні засоби
ефектів. Біологічна психіатрія 2011, 70:663�671.
174. Потвін С., Стіп Е., Сепері А.А., Гендрон А., Бах Р., Куасі Е.: Запальний
Зміни цитокінів при шизофренії: систематичний кількісний огляд.
Біологічна психіатрія 2008, 63:801�808.
175. Реале М, Патруно А, Де Лутііс М.А., Пеше М., Фелако М., Ді Джаннантоніо М., Ді
Нікола М, Гріллі А: Порушення регуляції виробництва хемоцитокінів у
хворі на шизофренію порівняно зі здоровими контрольною групою. BMC Neurosci 2011, 12:13.
176. Fluitman SB, Denys DA, Heijnen CJ, Westenberg HG: Відраза впливає на TNFalpha,
Рівні ІЛ-6 та норадреналіну у пацієнтів з обсесивно-компульсивними станами
розлад. Психонейроендокринологія 2010, 35:906�911.
177. Конук Н., Текін І.О., Озтюрк У., Атик Л., Атасой Н., Бектас С., Ердоган А.: Плазма
рівні фактора некрозу пухлин-альфа та інтерлейкіну-6 у обсесивних
компульсивний розлад. Медіатори Inflamm 2007, 2007: 65704.
178. Монтелеоне П., Катапано Ф., Фабраццо М., Торторелла А., Май М.: Зменшено
рівні в крові фактора некрозу пухлини-альфа у пацієнтів з обсесивно-компульсивними станами
розлад. Нейропсихобіологія 1998, 37:182�185.
179. Марацціті Д., Преста С., Пфаннер С., Джеміньяні А., Россі А., Сбрана С., Роккі В.
Ambrogi F, Cassano GB: Імунологічні зміни у дорослих обсесивно-компульсивних
розлад. Biol Psychiatry 1999, 46:810-814.
180. Zai G, Arnold PD, Burroughs E, Richter MA, Kennedy JL: Некроз пухлини
Ген фактор-альфа не пов'язаний з обсесивно-компульсивним розладом.
Psychiatr Genet 2006, 16:43.
181. Родргес А.Д., Гонселес П.А., Гарча М.Дж., де ла Роза А., Варгас М., Марреро Ф.:
Циркадні варіації концентрації прозапальних цитокінів у гострій формі
інфаркт міокарда. Rev Esp Cardiol 2003, 56:555-560.
182. Олівер JC, Bland LA, Oettinger CW, Arduino MJ, McAllister SK, Aguero SM,
Favero MS: Кінетика цитокінів у моделі цільної крові in vitro
виклик ендотоксину. Lymphokine Cytokine Res 1993, 12:115-120.
183. Le T, Leung L, Carroll WL, Schibler KR: Регуляція гена інтерлейкіну-10
вираз: можливі механізми, що враховують його підвищення та за
дозрівання відмінності в його експресії мононуклеарними клітинами крові.
Кров 1997, 89:4112�4119.
184. Лі MC, Ting KK, Adams S, Brew BJ, Chung R, Guillemin GJ:
Характеристика експресії NMDA-рецепторів у людини
астроцити. PLoS One 2010, 5:e14123.
185 Myint AM, Kim YK, Verkerk R, Scharpe S, Steinbusch H, Leonard B:
Кінуреніновий шлях при великій депресії: ознаки порушення
нейропротекція. J Affect Disord 2007, 98:143�151.
186. Санакора Г., Треккані Г., Пополі М.: До глутаматної гіпотези
депресія: новий рубіж нейропсихофармакології для
розлади настрою. Нейрофармакологія 2012, 62:63�77.
187. Салех А., Шротер М., Йонкманнс К., Хартунг Х.П., Моддер У., Джандер С.: В
vivo МРТ запалення мозку при ішемічному інсульті людини. Мозок 2004,
127: 1670�1677.
188. Tilleux S, Hermans E: Нейрозапалення та регуляція гліального глутамату
поглинання при неврологічних розладах. J Neurosci Res 2007, 85:2059�2070.
189. Helms HC, Madelung R, Waagepetersen HS, Nielsen CU, Brodin B: In vitro
докази гіпотези виходу глутамату з мозку: ендотеліальний мозок
клітини, культивовані разом з астроцитами, демонструють поляризований зв’язок між мозком і кров’ю
транспортування глутамату. 2012, 60:882�893.
190. Леонард Б.Є.: Концепція депресії як дисфункції імунної системи
системи. Curr Immunol Rev 2010, 6:205�212.
191. Labrie V, Wong AH, Roder JC: Внесок D-серинового шляху до
шизофренія. Нейрофармакологія 2012, 62:1484�1503.
192. Грас Дж., Сама Б., Юберт А., Леоне С., Поршере Ф., Ріманіоль AC: EAAT
експресія макрофагами та мікроглією: ще більше питань, ніж
відповідей. Амінокислоти 2012, 42:221�229.
193. Лівінгстон PD, Dickinson JA, Srinivasan J, Kew JN, Wonnacott S:
Перехресні зв’язки глутамат-дофамін у префронтальній корі щурів модулюються нікотиновими рецепторами Alpha7 і посилюються PNU-120596. J Mol
Neurosci 2010, 40:172�176.194. Kondziella D, Brenner E, Eyjolfsson EM, Sonnewald U: Як діють гліальнейрональні
взаємодії вписуються в сучасні гіпотези нейромедіаторів
шизофренія? Neurochem Int 2007, 50:291-301.
195. Wu HQ, Pereira EF, Bruno JP, Pellicciari R, Albuquerque EX, Schwarcz R: The
антагоніст нікотинових рецепторів альфа7 кінуренової кислоти, отриманий з астроцитів
контролює рівень позаклітинного глутамату в префронтальній корі. J Mol
Neurosci 2010, 40:204�210.
196. Steiner J, Bogerts B, Schroeter ML, Bernstein HG: білок S100B в
нейродегенеративні розлади. Clin Chem Lab Med 2011, 49:409�424.
197. Штайнер Дж., Марквардт Н., Паулс І., Шільц К., Рахмуне Х., Бан С., Богертс Б.
Шмідт Р.Е., Якобс Р.: Людські CD8(+) Т-клітини та NK-клітини експресують і
секретують S100B при стимуляції. Brain Behav Immun 2011, 25:1233�1241.
198. Shanmugam N, Kim YS, Lanting L, Natarajan R: Регулювання
експресія циклооксигенази-2 в моноцитах шляхом лігування рецептора
для передових кінцевих продуктів глікації. J Biol Chem 2003, 278:34834-34844.
199. Ротермундт М, Орман П, Абель С, Зігмунд А, Педерсен А, Понат Г,
Суслоу Т., Пітерс М., Кестнер Ф., Хайндель В., Арольт В., Пфлейдерер Б.: Гліальна клітина
активація в підгрупі хворих на шизофренію, на яку вказує
підвищення концентрації S100B у сироватці та підвищення міоінозитолу.
Prog Neuropsychopharmacol Biol Psychiatry 2007, 31:361–364.
200. Фальконе Т., Фаціо В., Лі Сі, Саймон Б., Франко К., Марчі Н., Джанігро Д.: Сироватка
S100B: потенційний біомаркер суїцидальності у підлітків? PLoS One
2010, 5:e11089.
201. Шротер М.Л., Абдул-Халік Х., Кребс М., Діфенбахер А., Блазіг І.Є.: Сироватка
маркери підтримують специфічну для захворювання гліальну патологію при великій депресії.
J Affect Disord 2008, 111:271�280.
202. Rothermundt M, An JN, Jorgens S: S100B при шизофренії: оновлення.
Gen Physiol Biophys 2009, 28 Spec No Focus: F76�F81.
203. Шротер М.Л., Абдул-Халік Х., Кребс М., Діфенбахер А., Блазіг І.Є.: Нейронспецифічні
енолаза не змінена, тоді як рівень S100B у сироватці крові підвищений
пацієнти з шизофренією – оригінальні дослідження та мета-аналіз.
Psychiatry Res 2009, 167:66�72.
204. Ротермундт М., Міслер У., Арольт В., Пітерс М., Ледбітер Дж., Вісманн М.,
Рудольф С., Вандінгер К.П., Кіршнер Х.: Підвищення рівня S100B у крові
Пацієнти з шизофренією, які не отримували медикаментів, пов’язані з
негативна симптоматика. Mol Psychiatry 2001, 6:445-449.
205. Сучанкова П, Кланг Дж, Каванна С, Холм Г, Нільссон С, Йонссон Е.Г., Екман А:
Чи має поліморфізм Gly82Ser в гені RAGE
шизофренія та психотизм особистості? J Psychiatry Neurosci
2012, 37:122–128.
206. Скапаньіні Г., Давінеллі С., Драго Ф., Де Лоренцо А., Оріані Г.: Антиоксиданти як
Антидепресанти: факт чи вигадка? Препарати ЦНС 2012, 26:477�490.
207. Ng F, Berk M, Dean O, Bush AI: Окислювальний стрес при психічних розладах:
доказова база та терапевтичні наслідки. Int J Neuropsychopharmacol
2008, 11:851–876.
208. Salim S, Chugh G, Asghar M: Запалення при тривожності. Adv Protein Chem
Структура біол 2012, 88:1�25.
209. Андерсон Г., Берк М., Додд С., Бехтер К., Альтамура А.С., Делльоссо Б., Канба С.,
Монджі А., Фатемі Ш., Баклі П., Дебнат М., Дас ЮН, Мейєр У., Меллер Н.,
Kanchanatawan B, Maes M: Імунозапальний, окислювальний і нітрозуючий
стрес, нейропрогресивні шляхи в етіології, перебігу та лікуванні
шизофренії. Prog Neuropsychopharmacol Biol Psychiatry 2013, 42:1�42.
210. Кофлін Дж.М., Ісідзука К., Кано С.І., Едвардс Дж.А., Сейфуддін Ф.Т., Шимано М.А.
Daley EL та ін.: Помітне зниження розчинної супероксиддисмутази-1
(SOD1) у спинномозковій рідині пацієнтів із нещодавнім початком захворювання
шизофренія. Mol Psychiatry 2012, 18:10�11.
211. Бомбачі М, Гріфантіні Р, Мора М, Регуцці В, Петракка Р, Меоні Е, Баллоні С,
Zingaretti C, Falugi F, Manetti AG, Margarit I, Musser JM, Cardona F, Orefici
G, Grandi G, Bensi G: Профілювання білкового масиву сироваток пацієнтів із тиком виявляє a
широкий спектр і посилена імунна відповідь проти групи А
Антигени стрептокока. PLoS One 2009, 4:e6332.
212. Валеріо А, Карділе А, Коцці В, Бракале Р, Тедеско Л, Пісконті А, Паломба Л,
Кантоні О, Клементі Е, Монкада С, Карруба М.О., Нізолі Е: TNF-альфа
знижує експресію eNOS і мітохондріальний біогенез в жирі
і м'язів огрядних гризунів. J Clin Invest 2006, 116:2791�2798.
213. Ott M, Gogvadze V, Orrenius S, Zhivotovsky B: Мітохондрії, окислювальні
стрес і загибель клітин. Апоптоз 2007, 12:913-922.
214. Шалев Х., Серлін Ю., Фрідман А.: Порушення гематоенцефалічного бар'єру як ворота
до психічного розладу. Cardiovasc Psychiatry Neurol 2009, 2009: 278531.
215. Abbott NJ, Ronnback L, Hansson E: Астроцит-ендотеліальні взаємодії на
гематоенцефалічний бар'єр. Nat Rev Neurosci 2006, 7:41.
216. Бехтер К, Райбер Х, Герцог С, Фукс Д, Тумані Х, Максейнер ХГ:
Аналіз спинномозкової рідини в афективному та шизофренічному спектрі
розлади: виявлення підгруп з імунними реакціями і
дисфункція гемато-лікворного бар'єру. J Psychiatr Res 2010, 44:321�330.
217. Харріс Л.В., Вейланд М., Лан М., Райан М., Гігер Т., Локстоун Х., Вутріх І.,
Міммак М, Ван Л, Коттер М, Креддок Р, Бан С: церебральний
мікроциркуляція при шизофренії: дослідження мікророзсічення лазерного захоплення.
PLoS One 2008, 3:e3964.
218. Лін Дж. Дж., Мула М., Герман Б. П.: Розкриття нейроповедінкової
супутні захворювання епілепсії протягом усього життя. Lancet 2012, 380:1180�1192.
219. Isingrini E, Belzung C, Freslon JL, Machet MC, Camus V: вплив флуоксетину на
аортальна вазорелаксація залежна від оксиду азоту в непередбачуваних випадках
Модель хронічного легкого стресу депресії у мишей. Psychosom Med 2012,
74: 63�72.
220. Чжан Сі, Чжоу Д.Ф., Цао Л.Й., Чжан П.Й., Ву Г.Й., Шен Ю.К.: Ефект
Лікування рисперидоном супероксиддисмутази при шизофренії. J Clin
Psychopharmacol 2003, 23:128-131.
221. Lavoie KL, Pelletier R, Arsenault A, Dupuis J, Bacon SL: Асоціація між
клінічна депресія та функція ендотелію, виміряна за допомогою передпліччя
гіперемійна реактивність. Psychosom Med 2010, 72:20�26.
222. Чрапко В., Юраш П., Радомскі М.В., Арчер С.Л., Ньюмен С.К., Бейкер Г., Лара Н.
Le Melledo JM: Зміна знижених метаболітів NO в плазмі та
Активність NO-синтази тромбоцитів пароксетином у пацієнтів з депресією.
Нейропсихофармакологія 2006, 31:1286�1293.
223. Чрапко WE, Jurasz P, Radomski MW, Lara N, Archer SL, Le Melledo JM:
Зниження активності синтази оксиду азоту тромбоцитів і оксиду азоту плазми
метаболіти при великому депресивному розладі. Biol Psychiatry 2004, 56:129-134.
224. Stuehr DJ, Santolini J, Wang ZQ, Wei CC, Adak S: Оновлення механізму
і каталітична регуляція в NO-синтазах. J Biol Chem 2004,
279: 36167�36170.
225. Чен В., Друхан Л.Й., Чен К.А., Хеманн Ч., Чен Ю.Р., Берка В., Цай А.Л., Цвайєр
JL: Пероксинітрит викликає руйнування тетрагідробіоптерину і
гем в ендотеліальній синтазі оксиду азоту: перехід від оборотного до
необоротне пригнічення ферментів. Біохімія 2010, 49:3129�3137.
226. Чен CA, Wang TY, Varadharaj S, Reyes LA, Hemann C, Talukder MA, Chen
YR, Druhan LJ, Zweier JL: S-глутатіонілування роз’єднує eNOS і
регулює його клітинну і судинну функцію. Природа 2010, 468:1115�1118.
227. Szabo C, Ischiropoulos H, Radi R: Пероксинітрит: біохімія,
патофізіології та розвитку терапевтичних засобів. Nat Rev Drug Discov
2007, 6:662–680.
228. Papakostas GI, Shelton RC, Zajecka JM, Etemad B, Rickels K, Clain A, Baer L,
Dalton ED, Sacco GR, Schoenfeld D, Pencina M, Meisner A, Bottiglieri T,
Nelson E, Mischoulon D, Alpert JE, Barbee JG, Zisook S, Fava M: Lmethylfolate
як додаткова терапія великої депресії, резистентної до СІЗЗС:
результати двох рандомізованих подвійних сліпих паралельно-послідовних досліджень. Ам Дж
Психіатрія 2012, 169:1267�1274.
229. Антоніадес С., Широдарія С., Уорік Н., Кай С., де Боно Дж., Лі Дж., Лісон П.,
Neubauer S, Ratnatunga C, Pillai R, Refsum H, Channon KM: 5-
метилтетрагідрофолат швидко покращує функцію ендотелію і
зменшує вироблення супероксиду в судинах людини: вплив на судини
наявність тетрагідробіоптерину та ендотеліальної синтази оксиду азоту
зчеплення. Тираж 2006, 114:1193�1201.
230. Масано Т., Кавасіма С., То Р., Сатомі-Кобаяші С., Шинохара М., Такая Т.,
Сасакі Н, Такеда М, Тава Х, Ямашіта Т, Йокояма М, Хірата К: корисно
вплив екзогенного тетрагідробіоптерину на ремоделювання лівого шлуночка
після інфаркту міокарда у щурів: можлива роль окисного стресу
спричинена несполученою ендотеліальною синтазою оксиду азоту. Circ J 2008,
72: 1512�1519.
231. Alp NJ, Channon KM: Регуляція ендотеліальної синтази оксиду азоту за допомогою
тетрагідробіоптерин при судинних захворюваннях. Arterioscler Thromb Vasc Biol 2004,
24: 413�420.
232. Шиманський С., Аштарі М., Зіто Дж., Ступінь Г., Богерц Б., Ліберман Дж.:
Гадоліній-DTPA посилене градієнтне ехо-магнітно-резонансне сканування в
Перший епізод психозу та хронічних хворих на шизофренію.
Psychiatry Res 1991, 40:203�207.
233. Батлер Т., Вайшольц Д., Айзенберг Н., Хардінг Е., Епштейн Дж., Стерн Е., Зільберсвейг
D: Нейровізуалізація лобно-лімбічної дисфункції при шизофренії та
Психози, пов'язані з епілепсією: до конвергентної нейробіології.
Epilepsy Behav 2012, 23:113�122.234. Батлер Т., Маоз А., Валлабхайосула С., Меллер Дж., Ічісе М., Пареш К., Первез Ф.,
Фрідман Д, Голдсміт С, Найджар С, Осборн Дж, Солнес Л, Ван Х, Френч Дж,
Тезен Т., Девінський О., Кузнецький Р., Штерн Е., Зільберсвейг Д.: Зображення
запалення у пацієнта з епілепсією, пов'язане з антитілами до
декарбоксилаза глутамінової кислоти [реферат]. У Am Epilepsy Society Abstracts,
Том 2. Балтимор: Американське епілепсійне товариство; 2011: 191.
235. ван Беркель Б.Н., Боссон М.Г., Боеллаард Р., Клоет Р., Шуйтемейкер А., Касперс
E, Luurtsema G, Windhorst AD, Cahn W, Lammertsma AA, Kahn RS:
Активація мікроглії при недавній шизофренії: кількісний (R)-
Дослідження позитронно-емісійної томографії [11C]PK11195. Біологічна психіатрія 2008 р.,
64: 820�822.
236. Дордуен Дж., де Фріз Е.Ф., Віллемсен А.Т., де Гроот Дж.К., Дірккс Р.А., Кляйн Х.К.:
Нейрозапалення при психозі, пов'язаному з шизофренією: ПЕТ дослідження.
J Nucl Med 2009, 50:1801-1807.
237. Такано А, Аракава Р, Іто Х, Татено А, Такахаші Х, Мацумото Р, Окубо Ю,
Сухара Т: Периферичні бензодіазепінові рецептори у пацієнтів із хронічним захворюванням
шизофренія: ПЕТ дослідження з [11C]DAA1106. Інт Дж
Neuropsychopharmacol 2010, 13:943-950.
238. Мюллер Н., Шварц М.Ю., Денінг С., Духе А., Черовецький А., Гольдштейн-Мюллер Б.
Spellmann I, Hetzel G, Maino K, Kleindienst N, Müller HJ, Arolt V, Riedel M:
Інгібітор циклооксигенази-2 целекоксиб має терапевтичний ефект
велика депресія: результати подвійного сліпого рандомізованого плацебо
контрольоване, додаткове пілотне дослідження до ребоксетину. Mol Psychiatry 2006,
11: 680�684.
239. Ахондзаде С, Джафарі С, Раїсі Ф, Насехі А.А., Горейші А, Салехі Б, Мохеббі Раса
S, Raznahan M, Kamalipur A: Клінічне випробування додаткового целекоксибу
лікування у пацієнтів з великою депресією: подвійне сліпе і
плацебо-контрольоване дослідження. Депресивна тривога 2009, 26:607�611.
240. Мендлевич Дж., Крівін П., Освальд П., Суері Д., Альбоні С., Брунелло Н.:
Укорочений початок дії антидепресантів при застосуванні великої депресії
Аугментація ацетилсаліцилової кислоти: пілотне відкрите дослідження. Int Clin
Psychopharmacol 2006, 21:227-231.
241. Uher R, Carver S, Power RA, Mors O, Maier W, Rietschel M, Hauser J,
Дерновсек М.З., Хенігсберг Н., Суері Д., Плачентіно А., Фармер А., МакГафін П.:
Нестероїдні протизапальні препарати та ефективність антидепресантів в
великий депресивний розлад. Psychol Med 2012, 42:2027�2035.
242. Мюллер Н., Рідель М., Шеппах С., Брандштаттер Б., Сокуллу С., Крампе К.,
Ulmschneider M, Engel RR, Moller HJ, Schwarz MJ: Корисний антипсихотичний засіб
ефекти додаткової терапії целекоксибом у порівнянні з рисперидоном окремо
шизофренія. Am J Psychiatry 2002, 159:1029-1034.
243. Мюллер Н., Рідель М., Шварц М.Дж., Енгель Р.Р.: Клінічні ефекти ЦОГ-2
інгібітори пізнання при шизофренії. Eur Arch Psychiatry Clin Neurosci
2005, 255:149–151.
244. Мюллер Н, Краузе Д, Денінг С, Музіл Р, Шеннах-Вольф Р, Обермайер М,
Moller HJ, Klauss V, Schwarz MJ, Riedel M: лікування целекоксибом на ранніх стадіях
стадія шизофренії: результати рандомізованого, подвійного сліпого, плацебо-контрольованого
Дослідження покращення лікування амісульпридом целекоксибу.
Schizophr Res 2010, 121:118-124.
245. Sayyah M, Boostani H, Pakseresht S, Malayeri A: Попередній рандомізований
Подвійне сліпе клінічне дослідження ефективності целекоксибу як допоміжного засобу
лікування обсесивно-компульсивного розладу. Psychiatry Res 2011,
189: 403�406.
246. Sublette ME, Ellis SP, Geant AL, Mann JJ: Мета-аналіз ефектів
ейкозапентаєнова кислота (EPA) у клінічних дослідженнях при депресії. J Clin
Психіатрія 2011, 72:1577�1584.
247. Bloch MH, Hannestad J: Омега-3 жирні кислоти для лікування
депресія: систематичний огляд і мета-аналіз. Mol Psychiatry 2012,
17: 1272�1282.
248. Келлер WR, Kum LM, Wehring HJ, Koola MM, Buchanan RW, Kelly DL: A
огляд протизапальних засобів щодо симптомів шизофренії.
J Psychopharmacol.
249. Уорнер-Шмідт Дж.Л., Вановер К.Е., Чень Е.Й., Маршалл Дж.Дж., Грінгард П.:
Антидепресивний ефект селективних інгібіторів зворотного захоплення серотоніну (СІЗЗС)
послаблюються протизапальними препаратами у мишей і людей. Proc Natl
Acad Sci USA 2011, 108:9262-9267.
250. Галлахер П. Дж., Кастро В., Фава М., Вайлбург Дж. Б., Мерфі С. Н., Гейнер В. С., Черчілль
SE, Kohane IS, Iosifescu DV, Smoller JW, Perlis RH: антидепресантна реакція
у пацієнтів з великою депресією, які піддавалися НПЗП: a
дослідження фармаконагляду. Am J Psychiatry 2012, 169:1065-1072.
251. Шелтон Р.К.: чи зменшує одночасне застосування НПЗП ефективність
антидепресанти? Am J Psychiatry 2012, 169:1012�1015.
252. Мартінес-Грас І, Перес-Ньевас Б.Г., Гарсія-Буено Б., Мадрігал Дж.Л., Андрес Естебан
Е, Родрігес-Хіменес Р., Хоєніка Дж., Паломо Т., Рубіо Г., Леза Дж.
Протизапальний простагландин 15d-PGJ2 та його ядерний рецептор
PPARгамма знижена при шизофренії. Schizophr Res 2011,
128: 15�22.
253. Гарсія-Буено Б., Перес-Ньевас Б.Г., Леза Дж.К.: Чи є роль ядерної
рецептора PPARgamma при нервово-психічних захворюваннях? Інт Дж
Neuropsychopharmacol 2010, 13:1411-1429.
254. Meyer U: Протизапальна сигналізація при шизофренії. Поведінка мозку
Immun 2011, 25:1507–1518.
255. Рамер Р., Хайнеманн К., Меркорд Дж., Роде Х., Саламон А., Ліннебахер М.
Hinz B: ЦОГ-2 і PPAR-гамма забезпечують апоптоз, індукований канабідіолом
клітин раку легенів людини. Mol Cancer Ther 2013, 12:69�82.
256. Генрі CJ, Huang Y, Wynne A, Hanke M, Gimler J, Bailey MT, Sheridan JF,
Godbout JP: міноциклін ослаблює ліпополісахариди (LPS)
нейрозапалення, хвороблива поведінка та ангедонія.
J Нейрозапалення 2008, 5:15.
257. Sarris J, Mischoulon D, Schweitzer I: Омега-3 для біполярного розладу: метааналіз
використовується при манії та біполярній депресії. J Clin Psychiatry 2012,
73: 81�86.
258. Аммінгер Г.П., Шафер М.Р., Папагеоргіу К., Клієр К.М., Коттон С.М., Харріган
SM, Mackinnon A, McGorry PD, Berger GE: довголанцюгові омега-3 жирні кислоти
для показаної профілактики психотичних розладів: рандомізований, плацебоконтрольований
суд. Arch Gen Psychiatry 2010, 67:146�154.
259. Fusar-Poli P, Berger G: Втручання ейкозапентаєнової кислоти в
шизофренія: мета-аналіз рандомізованих плацебо-контрольованих досліджень.
J Clin Psychopharmacol 2012, 32:179-185.
260. Zorumski CF, Paul SM, Izumi Y, Covey DF, Mennerick S: Нейростероїди,
Стрес і депресія: Потенційні терапевтичні можливості.
Neurosci Biobehav Rev 2013, 37:109�122.
261. Uhde TW, Singareddy R: Біологічні дослідження тривожних розладів. в
Психіатрія як нейронаука. Під редакцією Хуана Хосе Л.І., Вольфганга Г., Маріо М.,
Норман С. Чічестер: John Wiley & Sons, Ltd; 2002:237�286.
262. Гібсон С.А., Корадо З., Шелтон Р.С.: Окислювальний стрес і глутатіон
відповідь у культурах тканин від людей з великою депресією.
J Psychiatr Res 2012, 46:1326–1332.
263. Nery FG, Monkul ES, Hatch JP, Fonseca M, Zunta-Soares GB, Frey BN,
Боуден CL, Soares JC: Целекоксиб як допоміжний засіб при лікуванні
депресивні або змішані епізоди біполярного розладу: подвійне сліпе,
рандомізоване плацебо-контрольоване дослідження. 2008, 23:87�94.
264. Levine J, Cholestoy A, Zimmerman J: Можливий антидепресивний ефект
міноциклін. 1996, 153:582.
265. Левковіц Ю., Мендлович С., Рівкс С., Брау Ю., Левкович-Вербін Г., Гал Г.,
Fennig S, Treves I, Kron S: подвійне сліпе рандомізоване дослідження
міноциклін для лікування негативних і когнітивних симптомів в
рання фаза шизопренії. J Clin Psychiatry 2010, 71:138-149.
266. Міяока Т., Ясукава Р., Ясуда Х., Хаяшіда М., Інагакі Т., Хорігучі Дж.
Можливий антипсихотичний ефект міноцикліну у пацієнтів з
шизофренія. Prog Neuropsychopharmacol Biol Psychiatry 2007, 31:304�307.
267. Міяока Дж., Ясукава Р., Ясуда Х., Хаясіда М., Інагакі Т., Хорігучі Дж.:
Міноциклін як додаткова терапія при шизофренії: відкрито
вивчення. 2008, 31:287�292.
268. Родрігес С.І., Бендер Джей-молодший, Маркус С.М., Снейп М., Рінн М., Сімпсон Х.Б.:
Міноциклінове посилення фармакотерапії при обсесивно-компульсивних станах
розлад: відкрите дослідження. 2010, 71:1247�1249.
doi:10.1186/1742-2094-10-43
Процитуйте цю статтю як: Najjar et al.: Neuroinflammation and psychiatric
захворювання. Журнал нейроінфламації 2013 10:43.
Закрити акордеон
Інформація в цьому документі на "Нейрозапалення та психічні захворювання" не призначений для заміни особистих стосунків із кваліфікованим медичним працівником або ліцензованим лікарем і не є медичною консультацією. Ми заохочуємо вас приймати рішення щодо охорони здоров’я на основі ваших досліджень і партнерства з кваліфікованим медичним працівником.
Інформація в блозі та обговорення обсягу
Наша інформаційна сфера обмежується хіропрактикою, опорно-руховим апаратом, фізичними препаратами, оздоровленням, що сприяє етіологічному вісцеросоматичні порушення у клінічних презентаціях, клінічній динаміці асоційованого соматовісцерального рефлексу, комплексах підвивиху, чутливих питаннях здоров’я та/або статей, темах та дискусіях з функціональної медицини.
Надаємо та презентуємо клінічне співробітництво з фахівцями різних галузей. Кожен фахівець керується своєю професійною сферою практики та юрисдикцією ліцензування. Ми використовуємо протоколи функціонального здоров’я та оздоровлення для лікування та підтримки догляду за травмами або розладами опорно-рухового апарату.
Наші відео, дописи, теми, предмети та висновки охоплюють клінічні питання, проблеми та теми, які стосуються та прямо чи опосередковано підтримують нашу клінічну практику.*
Наш офіс обґрунтовано намагався надати підтверджувальні цитати та визначив відповідне дослідження або дослідження, що підтверджують наші публікації. За запитом ми надаємо копії допоміжних наукових досліджень, доступні регуляторним комісіям та громадськості.
Ми розуміємо, що ми розглядаємо питання, які потребують додаткового пояснення того, як це може допомогти в певному плані догляду або протоколі лікування; тому для подальшого обговорення вищезазначеної теми, будь ласка, не соромтеся запитувати Доктор Алекс Хіменес, округ Колумбія, Або зв'яжіться з нами за адресою 915-850-0900.
Ми тут, щоб допомогти вам та вашій родині.
Благословення
Д-р Алекс Хіменес Постійного струму, MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
електронна пошта: coach@elpasofunctionalmedicine.com
Ліцензія доктора хіропрактики (DC) у Техас & Нью-Мексико*
Техас, округ Колумбія, номер ліцензії TX5807, Нью-Мексико, округ Колумбія Номер ліцензії NM-DC2182
Ліцензія дипломованої медсестри (RN*) in Флорида
Ліцензія Флориди Ліцензія RN # RN9617241 (Контрольний номер 3558029)
Компактний статус: Мультидержавна ліцензія: Уповноважений на практику в Стани 40*
Доктор Алекс Хіменес, округ Колумбія, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Моя цифрова візитна картка