Після перетину периферичного нерва верхньої кінцівки та хірургічного лікування деякі пацієнти відновлюють хорошу сенсомоторну функцію, а інші – ні. Розуміння периферичних і центральних механізмів, які сприяють одужанню, може сприяти розробці нових терапевтичних заходів. Пластичність після перерізу периферичного нерва була продемонстрована по всій нейроосі на тваринних моделях ушкодження нерва. Однак зміни в мозку, які відбуваються після перетину периферичного нерва та хірургічного відновлення у людей, не досліджувались. Крім того, не охарактеризовано, наскільки регенерація периферичних нервів впливає на функціональні та структурні зміни мозку. Тому ми запитали, чи супроводжуються функціональні зміни структурними змінами сірої та/або білої речовини та чи пов’язані ці зміни з відновленням чутливості? Для вирішення цих ключових проблем ми (i) оцінили регенерацію периферичних нервів; (ii) виміряна функціональна магнітно-резонансна томографія активації мозку (сигнал, що залежить від рівня кисню в крові; BOLD) у відповідь на вібротактильний стимул; (iii) досліджували структурну пластичність мозку сірої та білої речовини; та (iv) корельовані заходи сенсорного відновлення зі змінами сірої речовини у пацієнтів із перерізом периферичного нерва та хірургічним відновленням. Порівняно зі здоровим протизапальним нервом у кожного пацієнта, перерізані нерви мають порушення нервової провідності через 1.5 роки після перетину та відновлення, проводячи зі зменшеною амплітудою та збільшеною латентністю. У порівнянні зі здоровими контрольними пацієнтами, перерізаними периферичними нервами та хірургічним ремонтом, була змінена сигнальна активність, що залежить від рівня кисню в крові, у первинній та вторинній соматосенсорній корі, а також у набору ділянок мозку, відомих як «мережа позитивних завдань». Крім того, було виявлено зменшення сірої речовини в кількох областях мозку, включаючи первинну та вторинну соматосенсорну кору головного мозку, у тих самих областях, де було виявлено зниження рівня сигналу в крові, залежне від рівня кисню. Крім того, витончення сірої речовини в постцентральній звивині негативно корелювало з заходами сенсорного відновлення (механічне та вібраційне виявлення), що демонструє чіткий зв’язок між функцією та структурою. Нарешті, ми виявили зменшену фракційну анізотропію білої речовини в правій острівці в області, яка також продемонструвала зменшення сірої речовини. Ці результати дають уявлення про пластичність мозку та взаємозв’язки структури-функції-поведінки після пошкодження нерва та мають важливі терапевтичні наслідки.
Ключові слова: товщина кори; фМРТ; дифузійне тензорне зображення; пластичність; ушкодження периферичного нерва
Скорочення: BA=область Бродмана; BOLD = залежить від рівня кисню в крові; fMRI=функціональна магнітно-резонансна томографія;
PNIr = перерізання периферичного нерва та хірургічне лікування; S1=первинна соматосенсорна кора; S2=вторинна соматосенсорна кора
зміст
Вступ
Після перетину периферичного нерва верхньої кінцівки та хірургічного відновлення (PNIr) ?25% пацієнтів не повернулися до роботи через 1.5 роки після операції (Jaquet et al., 2001). Крім того, ?57% пацієнтів з ушкодженнями нервів - це вік від 16 до 35 років (McAllister et al., 1996); таким чином, тривала інвалідність та економічні труднощі можуть супроводжувати перетин нерва верхньої кінцівки. Розуміння центральних і периферичних наслідків ураження периферичних нервів може сприяти розробці нових терапевтичних стратегій і програм втручання.
Невідомо, як мозок реагує на PNIr у людей. Однак дослідження на тваринах встановили, що пластичність соматосенсорної кори починається відразу після перетину периферичного нерва, і що через 1 рік після повного перерізу нерва та хірургічного відновлення кортикальні карти містять нерівні, неперервні зображення перерізаних і сусідніх нервів (Wall et al. ., 1986). Вважається, що механізми, що полегшують функціональну пластичність, включають негайне розкриття вже існуючих проекцій із сусідніх кортикальних і підкіркових рівнів і довготривале проростання аксонів на багатьох рівнях нейровісі, включаючи первинну соматосенсорну кору (S1) (Флоренс і Каас). , 1995; Хікмот та Стін, 2005).
Дослідження візуалізації мозку людини підтвердили висновки на тваринних моделях з ідентифікацією змінених функціональних карт активації МРТ внаслідок травми спинного мозку, ампутації, перенесення з пальця на великий палець, а також у пацієнтів із тунельним синдромом плодів (Lotze et al., 2001); Manduch et al., 2002; Jurkiewicz et al., 2006; Napadow et al., 2006). Крім того, структурні дослідження МРТ нещодавно візуалізували зміни сірої та білої речовини після травматичних ушкоджень і при різних патологічних станах, включаючи ампутацію кінцівки та хронічний біль (Apkarian et al., 2004; Draganski et al., 2006; Davis et al., 2008); Геха та ін., 2008; травень, 2008). Вважається, що зміни сірої речовини пов’язані зі зміною розміру клітин, атрофією та/або втратою нейронів або глії, тоді як зміни білої речовини впливають на аксональну дегенерацію та втрату мієліну (Beaulieu, 2002; травень, 2008).
Потужним підходом до визначення механізмів патології та пластичності є поєднання функціональних і структурних методів візуалізації сірої та білої речовини. Раніше ми повідомляли, що пацієнти з повним PNIr верхніх кінцівок зберігали глибокий соматосенсорний дефіцит, який зберігався протягом 41.5 років після операції (Taylor et al., 2008a). На основі цих висновків ми прийшли до висновку, що у цих пацієнтів будуть виявлятися функціональні та структурні зміни мозку в ключових соматосенсорних областях мозку. Тому в цьому дослідженні ми припустили, що пацієнти з PNIr будуть мати: (i) знижені відповіді, залежні від рівня кисню в крові (BOLD) на вібраційну стимуляцію перерізаної нервової території, в області S1, яка представляє пошкоджену верхню кінцівку, і у вторинній соматосенсорна кора (S2); (ii) відповідне зменшення товщини кори в цих областях протилежних S1 і S2; (iii) кореляція між змінами товщини кори та психофізичними показниками соматосенсорної функції (пороги виявлення вібрації та дотику); та (iv) знижена фракційна анізотропія (міра цілісності білої речовини) білої речовини, що подається в/виходить із цих соматосенсорних кортикальних зон.
Методи
Тематика
Ми залучили 27 пацієнтів з повним перерізом серединного та/або ліктьового нерва з подальшим хірургічним лікуванням від пластичних хірургів, які працюють у програмі Університету Торонто в період з червня 2006 року по травень 2008 року. З цієї більшої когорти 14 безболісних пацієнтів (три жінки , 11 чоловіків; 34 ± 10 років) з повним перерізом правого серединного та/або ліктьового нерва були включені в дослідження [щоб уникнути плутанини, пов’язаної з наявністю болю та латерального болю у пацієнтів з болем (n=6) та лівобічними ураженнями (n=7) були виключені з цього аналізу]. Усім пацієнтам було проведено мікрохірургічне відновлення нервів щонайменше за 1.5 роки до зарахування до дослідження (час відновлення варіювався від 1.5 до 8 років). Крім того, ми взяли на роботу 14 здорових осіб з контролю за віком і статтю (3 жінки, 11 чоловіків; 34 × 10 років). Усі суб’єкти дали інформовану письмову згоду на процедури, затверджені Радою з етики досліджень Мережі охорони здоров’я університету. Усі суб’єкти були правшами (визначено за допомогою Единбурзького інвентарю рукоюкості: Oldfield, 1971) і не мали в анамнезі неврологічних травм чи хронічного болю (до або після перерізу нерва). Див. таблицю 1 для демографічних подробиць.
Вивчати дизайн
Усі суб’єкти брали участь у сесії візуалізації, яка включала: (i) функціональну магнітно-резонансну томографію (фМРТ) у відповідь на вібротактильні подразники, прикладені до вказівного пальця правої руки (в межах території серединного нерва); (ii) анатомічне сканування всього мозку з високою роздільною здатністю, отримане для реєстрації зображення та аналізу сірої речовини кори; та (iii) два сканування зображення тензором дифузії для оцінки цілісності білої речовини. Перед візуалізації суб’єкти були проінструктовані щодо базової конструкції експерименту та нагадали, щоб вони залишалися якомога нерухомими протягом усього сканування.
Суб'єкти мали право вийти з дослідження в будь-який час. Крім того, для всіх випробовуваних було проведено сенсорну та моторну оцінку (Taylor et al., 2008a). Оскільки пороги виявлення дотику та вібрації були пов’язані з товщиною кори, опис цих методів наведено нижче (інші психофізичні заходи будуть описані в іншому місці).
Поріг вібрації
Пороги виявлення вібрації визначали за допомогою ручного біотезіометра (Bio-Medical Instrument Company, США). Пристрій має 12-мм зонд, який поміщають на дистальну фалангу правого вказівного пальця (D2). Пороги визначали за допомогою методу меж: амплітуду (напругу) поступово збільшували до тих пір, поки випробуваний не вказав, що сприймає подразник. Пороги вібрації були отримані тричі та розраховано середнє значення. Під час тестування вібраційного порогу випробуваним було вказано закрити очі і покласти тильну сторону долоні на підтримуючу подушку.
Поріг механічного виявлення
Пороги механічного виявлення були визначені за допомогою стандартизованого набору волокон Фрея (OptiHair2 Marstock Nervtest, Німеччина), що містить 12 логарифмічно розташованих каліброваних ниток, які створювали зусилля від 0.25-512 мН. Діаметр контактної поверхні всіх 12 ниток становив ~0.4 мм. Випробування проводилися із закритими очима суб’єкта та руками, які спиралися на м’яку подушку. Зонди застосовувалися в зростаючому ряду, і суб’єкти повинні були давати відповідь щоразу, коли вони відчували, що зонд торкається правого кінчика пальця D2. Цей процес повторювався тричі. Сила для нитки, яка була виявлена принаймні в двох із трьох випробувань, була зазначена як поріг механічного виявлення суб’єкта.
Тестування нервової провідності
Пацієнти брали участь у двосторонніх дослідженнях провідності чутливих і рухових нервів у клініці електроміографії (EMG) Західної лікарні Торонто. Для проведення рухового нерва стимулюючий електрод розташовували на зап’ясті та лікті (окремо), а реєструючий електрод поміщали над коротким відвідним м’язом, для оцінки серединного нерва, або мінімальним відвідним пальцем для оцінки ліктьового нерва. Для перевірки чутливих нервів реєструючий електрод розміщували на зап’ясті, а стимулюючий електрод – на цифрах D2, D3 і D5. Старший досвідчений невролог із клініки EMG Western Hospital Торонто (д-р Пітер Ешбі) переглянув усі клінічні оцінки, щоб визначити, які нерви продемонстрували нормальну/ненормальну реакцію. Оскільки відомо, що показники амплітуди та затримки суттєво відрізняються між суб’єктами (через такі фактори, як щільність іннервації, глибина нерва та товщина шкіри окремого суб’єкта) (Kimura, 2001), неперерізаний нерв у кожного пацієнта служили власним контролем для порівняння зі значеннями з боку перерізу. У пацієнтів із виявленими реакціями нервової провідності були проведені парні t-тести, щоб оцінити різницю в показниках латентності або амплітуди між перерізаним і неперерізаним нервами кожного пацієнта.
Параметри зображення
Дані візуалізації мозку були отримані за допомогою системи МРТ 3T GE, оснащеної восьмиканальною головною котушкою з фазованою решіткою. Суб'єктів клали на спину на столі для МРТ, а голову кожного досліджуваного накладали м'якими, щоб зменшити рух. Дані фМРТ всього мозку були отримані за допомогою планарної ехо-зображення (28 осьових зрізів, поле зору (FOV) = 20 x 20 см, 64 x 64 матриці, 3.125 x 3.125 x 4 мм вокселів, час відлуння (TE) = 30 мс, повторення час (TR) = 2000 мс). Час сканування становив 5 хв 8 с (154 кадри). Під час сканування до дистальної фаланги правого D12 було застосовано безболісний вібротактильний стимул з частотою 2 Гц за допомогою балонних діафрагм, які приводилися в рух стисненим повітрям (пристрій виробництва д-ра Крісто Пантева; www.biomag.uni-muenster.de). Стимули доставлялися блоками по 10 секунд, що чергуються з 20 секундами відпочинку, загалом 10 блоків стимуляції та 10 блоків відпочинку. Перші 8 с (4 TR) даних, отриманих під час кожного запуску, були відкинуті, щоб забезпечити врівноваження сигналу фМРТ. Суб'єктам було наказано тримати очі закритими під час сканування та зосереджуватись на подразниках. Тривимірне (3D) анатомічне сканування з високою роздільною здатністю всього мозку (124 сагітальні зрізи, 24 x 24 см FOV, 256 x� 256 матриця, 1.5 x 0.94 x 0.94 мм вокселів) було отримано за допомогою T1-зваженої 3D-послідовності з градієнтом спойхо (середнє значення одного сигналу, кут перевороту = 20?, TE ?5 мс). Крім того, було отримано два сканування зображення тензором дифузії (38 осьових зрізів, FOV 24 x 24 см, 128 x 128 матриця, 1.875 x 1.875 x 3 мм вокселів) уздовж 23 напрямків із значенням b 1000 см�2. Кожен запуск також містив два томи без дифузійного зважування.
Аналіз fMRI
Дані аналізували за допомогою Brainvoyager QX v1.8 (Brain Innovaton, Маастрихт, Нідерланди). Попередня обробка включала: тривимірну корекцію руху, корекцію часу сканування зрізу, видалення лінійної тенденції, високочастотну фільтрацію (п’ять циклів за запуск) і просторове згладжування з 3 мм повною шириною на половині максимуму (FWHM) гауссовим ядром. Набори даних фМРТ були інтерпольовані до вокселів 6 x 3 x 3 мм, зареєстровані на анатомічне зображення з високою роздільною здатністю та нормовані на стандартний простір Талайраха (Talairach and Tournoux, 3). Воксели вказуються як 1988 x 1 x 1 мм. Дані аналізували за допомогою загальної лінійної моделі; модель була отримана шляхом згортання функції бокскар часового перебігу тактильної стимуляції зі стандартною функцією гемодинамічної реакції. Для виявлення між груповими відмінностями у моделях активації був проведений аналіз фіксованих ефектів із контрастами: (i) здорові контрольні групи: стимуляція 1 відпочинок; (ii) PNIr: стимуляція 4 відпочинок; та (iii) здорові контрольні особи 4 PNIr. Карти активації були встановлені на виправленому значенні P4 (отримано з невиправлених суміжних вокселів P50.05 і 50.0001 мм120, як повідомлялося раніше: Taylor and Davis, 3); це також було підтверджено за допомогою моделювання Монте-Карло за допомогою програми AlphaSim, реалізованої в програмному забезпеченні Analysis of Functional Neuroimage (AFNI). Цей аналіз включав лише 2009 пацієнтів, у яких була стійка перерізка правого серединного нерва (n=11) або правого серединного та ліктьового нервів (n = 9) (тобто три пацієнти з чистою перерізкою правого ліктьового нерва не були включені в цей аналіз ).
Аналіз товщини кори
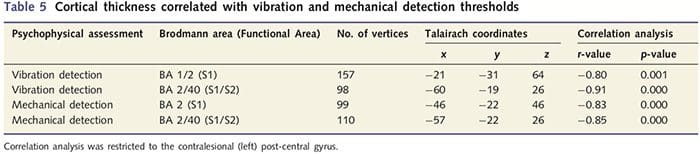
Аналіз товщини кори проводили за допомогою Freesurfer (http://surfer.nmr.mgh.harvard.edu); методи були детально описані в інших місцях (Dale et al., 1999; Fischl et al., 1999a, b; Fischl and Dale 2000). Коротше кажучи, в атласі Talairach були зареєстровані T1-зважені набори анатомічних даних з високою роздільною здатністю (Talairach and Tournoux, 1988). Далі йшла нормалізація інтенсивності, зняття черепа та відділення півкуль. Згодом були визначені та сегментовані межі біла/сіра речовина (звана білою поверхнею) та сіра/лікворова поверхня (так звана піальна поверхня). Потім розраховували відстань між білою та піальною поверхнями в кожній точці кожної півкулі мозку. Щоб визначити групові відмінності між 14 пацієнтами та 14 контрольними групами, відповідними за віком і статтю, загальний аналіз лінійної моделі було проведено в кожній точці мозку. Оскільки індивідуальна кортикальна топографія за своєю суттю неоднорідна, перед статистичним аналізом було застосовано ядро просторового згладжування шириною 5 мм FWHM. Дані відображаються за виправленим P50.05 (отриманим з невиправленого P50.0075 і 102 суміжних вершин); це було розраховано за допомогою моделювання Монте-Карло за допомогою AlphaSim. Вершина являє собою точку на двовимірному аркуші, і в цьому дослідженні відстань між двома вершинами становить 0.80 мм2.
Оскільки у пацієнтів спостерігався значний дефіцит соматосенсорної функції на території перерізаного нерва, ми припустили, що показники соматосенсорної функції (вибрація та виявлення дотику) будуть корелювати з товщиною кори в контралезійній постцентральній звивині (первинна та вторинна соматосенсорна кора). Тому ми провели кореляційний аналіз у групі пацієнтів між: (i) товщиною кори та порогом виявлення вібрації; та (ii) товщина кори та пороги виявлення дотику. Один пацієнт не пройшов психофізичну оцінку; отже, цей аналіз включав 13 пацієнтів із ПНІР. Крім того, щоб визначити, чи існує зв’язок між товщиною кори головного мозку та часом відновлення, був також проведений кореляційний аналіз між цими двома показниками. Ці кореляційні аналізи були обмежені контрлезійною постцентральною звивиною шляхом включення маски (взято з атласу Freesurfer) у загальну лінійну модель. Було виконано моделювання за методом Монте-Карло, яке обмежувалося кількістю вершин у контралезійній постцентральній звивині; зображення відображаються з виправленим P50.05 (отриманим з невиправленого P50.0075 і 68 суміжних вершин).
Аналіз зображення тензором дифузії
Обробку зображень тензором дифузії проводили за допомогою DTiStudio (www.MriStudio.org) та FSLv.4.0 (www.fmrib.ox.ac.uk/fsl/). Зображення вперше були вирівняні за допомогою інструмента автоматичної реєстрації зображень, реалізованого в DTiStudio, використовуючи перше зображення B0 з першої серії, отримане як шаблон. Цей процес коригує рух об’єкта та спотворення вихрових струмів. Потім усі зображення були перевірені візуально, щоб оцінити якість зображення та вирівнювання окремих циклів зображення тензора дифузії. Якщо було виявлено артефакт, зріз видаляли перед обчисленням середнього значення для двох окремих циклів зображення тензора дифузії. Окремі карти FA були розраховані за допомогою інструменту DTIFIT, реалізованого у FSL. Було проведено статистичний аналіз вокселів для визначення групових відмінностей у середній дробовій анізотропії з використанням просторової статистики на основі тракту; для повного опису цих методів див. Smith et al. (2006). Коротше кажучи, зображення були нелінійно зареєстровані для цільового зображення (MNI152), середнє зображення було створено з усіх наборів даних, і це зображення згодом було розріджено, щоб представити всі ділянки, які були загальними для всіх суб’єктів. Найвищі значення дробової анізотропії кожного суб’єкта потім проектувалися на скелет шляхом пошуку в білій речовині перпендикулярно кожній точці на скелеті білої речовини. Потім між групами (14PNIr і 14 здорових контрольних осіб) проводили статистичний аналіз всього мозку вокселів, а зображення коригували весь мозок на рівні P50.05. Крім того, у білій речовині проводили аналіз області, що представляє інтерес тракти прилягає до контралатеральної S1, таламуса та двосторонньої передньої та задньої острівців. Ці області були обрані, оскільки вони раніше були залучені до аспектів соматосенсації і тому, що вони відповідають ділянкам, які були ідентифіковані в груповому аналізі фМРТ та аналізу товщини кори (CTA). Ділянки, що представляють інтерес, були намальовані на скелеті білої речовини наступним чином: (i) Контралатеральна область S1, що представляє інтерес, виникла медіально на стику між скелетом білої речовини променевої корони та ділянкою скелета, що живиться в постцентральну звивину; закінчується в кінці тракту в межах даного фрагмента.
У напрямку z область інтересу розширювалася від z=49 до 57; шляхи білої речовини, що живлять область рук. (ii) Контралатеральна область таламуса, що цікавить, була обмежена доріжками білої речовини, що оточують заднє та медіальне ядра таламуса (ядра, які беруть участь у соматосенсорних функціях), простягаючись від z = �1 до 4. (iii) Острівні області, що представляють інтерес, були намальовані двосторонньо в межах біла речовина, що прилягає до передньої та задньої острівців, на основі критеріїв, раніше опублікованих нашою лабораторією (Taylor et al., 2008b). Область інтересу розширювалася з z = 2 до 8. Значення дробової анізотропії були виділені з кожної з цих областей, що цікавлять, і багатовимірний дисперсійний аналіз (MANOVA) був виконаний з використанням Statistical Package for the Social Sciences v13.0 (SPSS Inc, Чикаго), який включав значення дробової анізотропії для всіх шести регіонів, що цікавлять.
результати
У таблиці 1 наведено демографічні дані для учасників дослідження. Усі 14 пацієнтів пережили повний перетин правого серединного та/або ліктьового нерва з подальшою мікрохірургічною операцією щонайменше за 1.5 роки до зарахування до дослідження. Час від операції до тестування становив від 1.5 до 8 років із середнім (?SD) 4.8 ? 3 роки. Пацієнти і контрольна група цього не зробили (34 ± 10 років обидві групи; t = 0.04; P = 0.97).
Психофізика
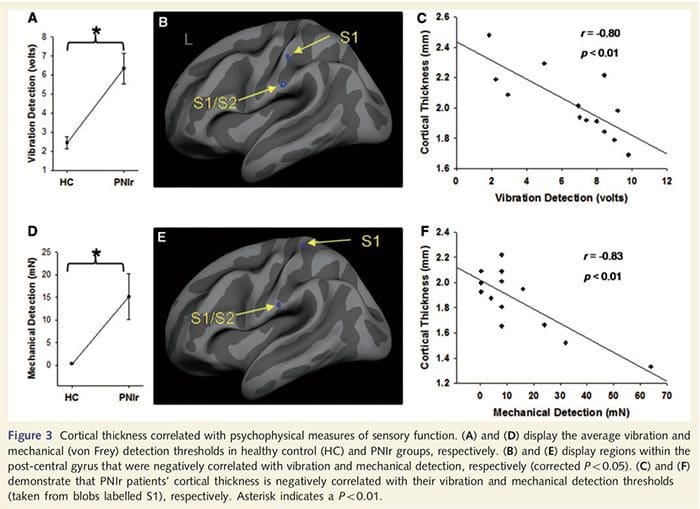
Пороги вібрації були розраховані на основі всіх трьох вимірювань, оскільки дисперсійний аналіз односторонніх повторних вимірювань (ANOVA) не показав суттєвих відмінностей між трьома випробуваннями [F (25, 1)=0.227, P=0.64]. Вібраційні та механічні пороги виявлення були значно знижені у пацієнтів із PNIr порівняно зі здоровими контролями (вібрація: t = 4.77, P50.001, рис. 3A; механічна: t=3.10, P=0.005, рис. 3D).
Тестування нервової провідності
Вимірювання амплітуди та латентності, отримані для кожного пацієнта з протизапальними нервами, були класифіковані як нормальні досвідченим неврологом із клініки EMG клініки Західної лікарні Торонто. Дев’ять із 14 пацієнтів пройшли тестування нервової провідності. У таблиці 2 наведено середні дані збільшення/зменшення затримки та амплітуди для чутливого нерва провідності від зап’ястя до короткого відвідного м’яза (медіана) або відвідного малого пальця (ліктьової), а також для сенсорної провідності від зап’ястя до D2 (медіана) і D5 ( ліктьовий) у порівнянні з кожним пацієнтом неушкодженого протизапального нерва. З дев’яти пацієнтів у семи пацієнтів були перерізи, які включали серединний нерв. З цих семи один пацієнт не мав відповіді, яку можна було виявити під час моторного тестування, а інший пацієнт не мав реакції під час сенсорного тестування.
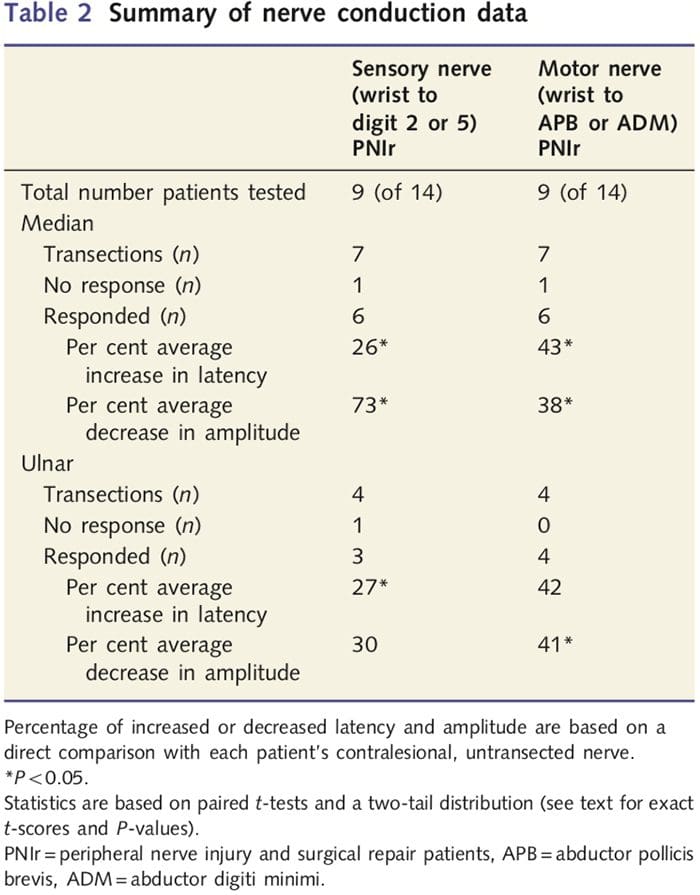 У шести пацієнтів із виявленими відповідями затримки рухової провідності були збільшені на 43% (t=6.2; P=0.002), а амплітуди зменшилися на 38% (t=�2.6; P=0.045), коли перерізаний нерв у кожного пацієнта був порівняно з їхньою стороною, яка не постраждала. Сенсорна провідність у серединних нервах також виявила збільшення латентності на 26% (t=3.9; P=0.011) і зниження амплітуди на 73% (t=�8.0; P=0.000) порівняно з нормальними контрацептивними нервами. У чотирьох пацієнтів із перерізом ліктьового нерва у одного пацієнта не було виявлено відповіді під час тестування чутливих нервів. У тих пацієнтів із відповідями латентність ліктьового нерва не була значно підвищеною (t = 2.8; P = 0.070); однак амплітуди були значними
У шести пацієнтів із виявленими відповідями затримки рухової провідності були збільшені на 43% (t=6.2; P=0.002), а амплітуди зменшилися на 38% (t=�2.6; P=0.045), коли перерізаний нерв у кожного пацієнта був порівняно з їхньою стороною, яка не постраждала. Сенсорна провідність у серединних нервах також виявила збільшення латентності на 26% (t=3.9; P=0.011) і зниження амплітуди на 73% (t=�8.0; P=0.000) порівняно з нормальними контрацептивними нервами. У чотирьох пацієнтів із перерізом ліктьового нерва у одного пацієнта не було виявлено відповіді під час тестування чутливих нервів. У тих пацієнтів із відповідями латентність ліктьового нерва не була значно підвищеною (t = 2.8; P = 0.070); однак амплітуди були значними
зменшився на 41% (t = �5.9; P = 0.010). Сенсорне тестування ліктьового нерва продемонструвало збільшення латентності на 27% (t = 4.3; P = 0.049), але без значного збільшення амплітуди (t = 3.5; P = 0.072).
Функціональна пластичність первинної соматосенсорної кори
Функціональні карти МРТ були розраховані на основі 11 пацієнтів PNIr з перерізами правого серединного нерва (пацієнти з перерізами ліктьового нерва були виключені з цього аналізу) та 11 здорових контрольних груп відповідного віку та статі. З рис. 1A видно, що пацієнти з PNIr мають значно меншу активацію порівняно зі здоровими контролями в області S1, що відповідає зоні Бродмана 2 (BA2) (Talairach and Tournoux, 1988) і S2 (див. таблицю 3 для деталей). . Середні відповіді, пов’язані з подіями, з цих регіонів, що представляють інтерес, підкреслюють ослаблену відповідь BOLD у пацієнтів зліва BA2 та лівого S2 (рис. 1B і C, відповідно). Цікаво, що вібротактильна стимуляція у пацієнтів активувала більш високу частину постцентральної звивини (ймовірно, BA1/3) (Talairach and Tournoux, 1988) (рис. 1А та таблиця 3). Середнє значення, пов’язане з подіями (рис. 1D), демонструє, що у здорових контрольних груп була мінімальна активація в цій області. Крім того, пацієнти мали значно більшу активацію в областях мозку, відомих як мережа позитивних завдань (зірочки на рис. 1). Дивіться таблицю 3 для повного списку активованих ділянок мозку, позитивних для виконання завдання. Ця мережа включає латеральну префронтальну, латеральну тім’яну, премоторну та нижню скроневу кори (Таблиця 3): ділянки мозку, які активуються під час виконання завдання, що вимагає уваги, і пригнічуються або неактивні під час відпочинку чи завдань, які не викликають когнітивних чи увага (Fox et. ін., 2005; ДеЛука та ін., 2006; Семіновіч та Девіс 2007).
Зменшення сірої речовини в первинній соматосенсорній корі корелює з відновленням чутливості
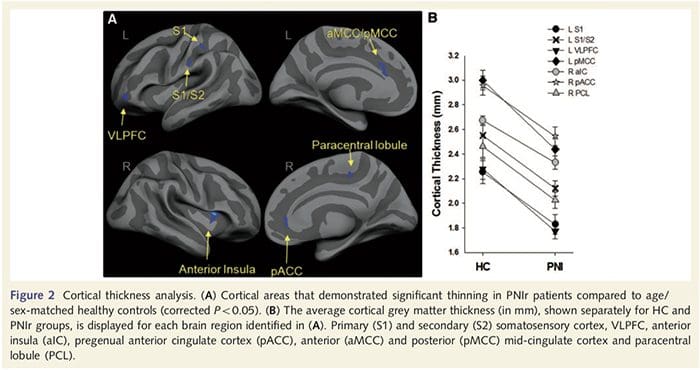
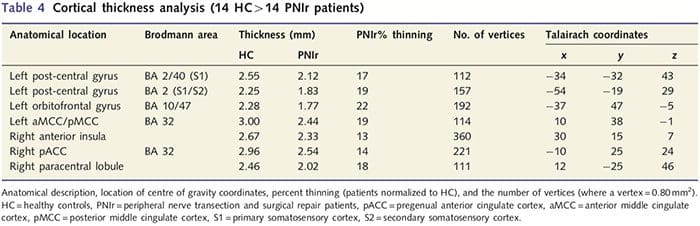
Аналіз товщини кори у всіх 14 пацієнтів та 14 здорових осіб контрольної групи відповідного віку та статі виявив декілька локусів значного витончення кори в групі PNIr (рис. 2 та таблиця 4). Зокрема, у пацієнтів спостерігалося зменшення товщини кори лівої (контралезійної) S13, S22, передгенуальної передньої поясної звивини, вентролатеральної префронтальної кори та правої передньої острівкової частини, передньої/задньої середньої поясної звивини та парацентральної часточки. Цікаво, що місця розрідження сірої речовини в постцентральній звивині збігаються з областями зменшеного BOLD після вібротактильної стимуляції (Таблиця 1). Оскільки ми попередньо знали про сенсорний дефіцит пацієнтів та час відновлення (тобто час після мікрохірургічного відновлення), ми потім запитали, чи корелює товщина кори пацієнтів у постцентральній звивині з їхніми сенсорними механічними та вібраційними порогами виявлення, або з їхніми час відновлення. Ці аналізи виявили негативну кореляцію між товщиною кори і порогами виявлення вібрації в області, що охоплює BA2/4 і S1 (P2, r=?2 і ?50.001, для BA0.80/0.91 і S1, відповідно; рис. 2 і таблиця 2 ). Крім того, пороги механічного виявлення також негативно корелювали з товщиною кори в трохи вищій області BA3 і тій же області S5 (P2, r = ?2 і ?50.001, для BA0.83 і S0.85, відповідно; рис. 2 і табл. 2). Однак ми не виявили значного зв’язку між часом відновлення та товщиною кори. Таким чином, витончення кори постцентральної звивини було пов’язано з більш серйозними сенсорними дефіцитами. Однак ми не виявили значного зв’язку між часом відновлення та товщиною кори. Знову ж таки, була відповідність між витонченням кори в областях, які негативно корелювали з вібраційними стимулами, та ділянками, які демонструють групові аномалії фМРТ і CTA.
Аномалії білої речовини після перерізу нерва
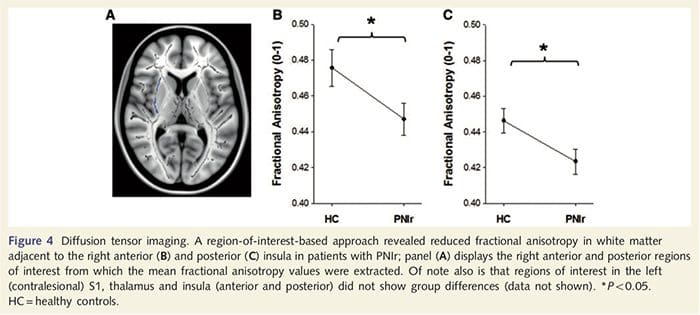
Щоб оцінити цілісність білої речовини, ми використали підхід, що представляє інтерес, для вивчення відмінностей груп білої речовини на основі апріорних гіпотез. Регіони, що представляють інтерес, були обмежені трактами білої речовини, що оточують і живляться в протилежний S1 і таламус. Крім того, ми також намалювали цікаві області білої речовини, що прилягають до лівої та правої, передньої та задньої острівців. Острівка була обрана, оскільки вона бере участь у соматосенсорній обробці та тому, що ми ідентифікували зменшену сіру речовину в правій передній острівці за допомогою CTA. Цей підхід до області інтересу показав, що пацієнти мали значно знижені значення фракційної анізотропії білої речовини (MANOVA, включаючи всі шість областей, що представляють інтерес), прилеглих до правої передньої частини [F (1, 26) = 4.39, P = 0.046; Рис. 4А] і задній острівці [F (1, 26) = 5.55, P = 0.026; 4B], але не було групових відмінностей у білій речовині, що прилягає до лівого острівця (лівий передній острівець: P = 0.51; лівий задні острівець: P=0.26), таламус (P=0.46) або S1 (P=0.46 ).
 Обговорення
Обговорення
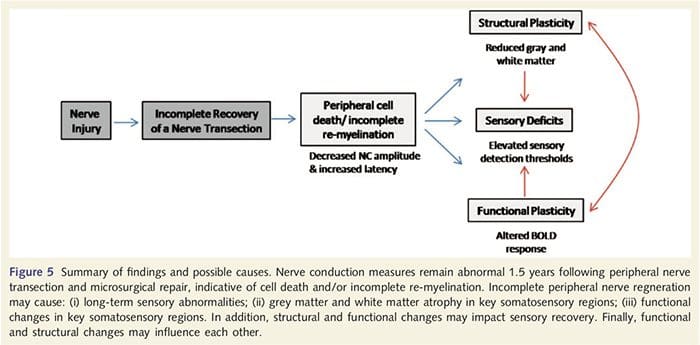
Тут ми вперше продемонстрували, що існує функціональна пластичність і структурні аномалії як сірої, так і білої речовини в кількох областях кори після перерізу периферичного нерва верхньої кінцівки та хірургічного відновлення. Ця пластичність може виникнути внаслідок неповної регенерації периферичних нервів (загибель периферичних клітин та/або неповна повторна мієлінізація), оскільки заходи нервової провідності у цих пацієнтів продемонстрували серйозні відхилення. Крім того, наші дані демонструють, що знижені реакції фМРТ, викликані вібротактильною системою, у постцентральній звивини відповідають стоншенню сірої речовини в групі пацієнтів. Ці результати свідчать про те, що зниження реакцій BOLD може сприяти зменшенню сірої речовини кіркової речовини та/або зменшення аферентного входу до постцентральної звивини. Крім того, товщина кори в цих же частинах постцентральної звивини негативно корелює з поведінковими показниками соматосенсорної функції. Тобто підвищений соматосенсорний дефіцит корелював із більш тонкою корою; обидва з них можуть бути пов’язані з аферентним введенням. Разом взяті, наші дані свідчать про те, що неповна регенерація периферичних нервів сприяє порушенням соматосенсорів, атрофії сірої речовини кіркового мозку та зниженню активації фМРТ (див. рис. 5 для короткого огляду цих результатів).
Добре відомо, що пластичність кори після перерізу периферичного нерва та хірургічного відновлення може відбуватися по всій ЦНС у приматів, відмінних від людини (Kaas, 1991). Вважається, що ця пластичність пов’язана з розкриттям раніше мовчазних синапсів або проростання аксонів на деаферентовану територію (Wall et al., 1986; Florence and Kaas, 1995). У моделі приматів, через 1 рік після перерізу нерва та хірургічного відновлення, денервована кора характеризується неповними та безладними репрезентаціями регенерованих та сусідніх (неушкоджених) нервів. Таке нерівне представлення пояснюється неповною периферичною регенерацією, що призводить до часткового відновлення денервованого коркового простору (Kaas, 1991). Щоб оцінити ступінь периферичної регенерації в нашій популяції пацієнтів, ми провели дослідження провідності чутливих і рухових нервів у перерізаній області. Наші результати нервової провідності демонструють, що у пацієнтів з PNIr значно зменшена амплітуда та збільшена латентність як чутливих, так і рухових нервів порівняно з їхньою власною нерозрізаною стороною. Зниження амплітуди в поєднанні зі збільшенням затримки вказує на втрату периферичних волокон (тобто загибель клітин) та/або аномальну або неповну повторну мієлінізацію після перетину (Kimura, 1984). Крім того, добре встановлено, що від 20% до 50% нейронів спинного корінця гинуть після перерізу нерва (Liss et al., 1996). Таким чином, загибель аферентних клітин і неповна регенерація можуть призвести до зниження аферентного введення в кору, що може пояснювати постійний сенсорний дефіцит і знижену відповідь BOLD в BA2 і S2. Крім того, це зменшене аферентне введення може також пояснити витончення кори, яке ми спостерігали в тих же областях кори. Було показано, що сенсорна депривація викликає транснейронну дегенерацію в кількох областях ЦНС, включаючи дорсальний ріг, що йде за відділом сідничного нерва (Knyihar-Csillik et al., 1989), і може включати нейрони другого і третього порядку (Powell and Ерулкар, 1962). Транснейронна дегенерація характеризується зморщуванням клітин і, як вважають, пов’язана зі зниженням або відсутністю аферентного введення (Knyihar-Csillik et al., 1989). Таким чином, втрата (або атрофія) сірої речовини коркового мозку також може бути безпосередньо пов’язана зі зниженням аферентного введення.
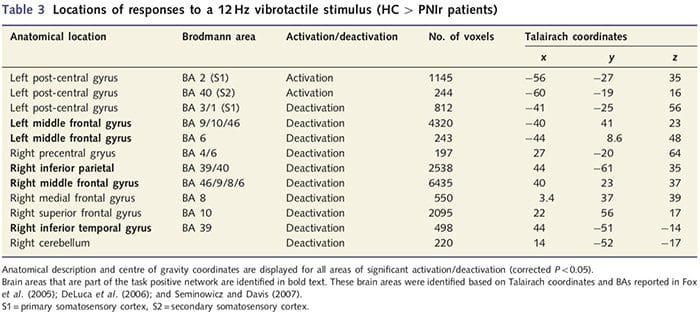
 Ми також продемонстрували підвищену активацію в постцентральній звивині в області, що відповідає BA1/3 (Talairach and Tournoux, 1988). Електрофізіологічні, анатомічні дослідження та дослідження нейровізуалізації встановили, що для більшості шкірних механорецептивних аферентів першими кірковими дестинаціями є BA1 та BA3b. Кожна з цих цитоархітектонічних областей мозку має соматотопну карту тіла з невеликими рецептивними полями. Крім того, ці області реагують на багато особливостей тактильної інформації, таких як текстура і шорсткість, швидкість і кривизна стимулів (Bodegard et al., 2001). Дослідження фМРТ продемонстрували, що на активність соматосенсорної кори головного мозку впливає увага, так що реакції фМРТ на тактильні подразники в S1 збільшуються, коли суб’єкти звертаються до тактильного стимулу, але послаблюються, коли суб’єкти відволікаються (Arthurs et al., 2004; Порро та ін., 2004). Крім того, наші пацієнти активували мережу ділянок мозку, відому як мережа позитивних завдань (DeLuca et al., 2006), більше, ніж здорові особи контролю. Ці ділянки мозку активуються під час процесів, які вимагають уваги (Fox et al., 2005; Seminowicz and Davis, 2007). Разом ці висновки свідчать про те, що пацієнти повинні звертати увагу на стимул більше, ніж на контрольну групу, через порушення сенсорного впливу. Ця підвищена увага може також пояснювати підвищену активацію BA1/3b. Звичайно, підвищена активація в BA1/3b також може відображати пластичність, яка не пов’язана з навантаженням на увагу.
Ми також продемонстрували підвищену активацію в постцентральній звивині в області, що відповідає BA1/3 (Talairach and Tournoux, 1988). Електрофізіологічні, анатомічні дослідження та дослідження нейровізуалізації встановили, що для більшості шкірних механорецептивних аферентів першими кірковими дестинаціями є BA1 та BA3b. Кожна з цих цитоархітектонічних областей мозку має соматотопну карту тіла з невеликими рецептивними полями. Крім того, ці області реагують на багато особливостей тактильної інформації, таких як текстура і шорсткість, швидкість і кривизна стимулів (Bodegard et al., 2001). Дослідження фМРТ продемонстрували, що на активність соматосенсорної кори головного мозку впливає увага, так що реакції фМРТ на тактильні подразники в S1 збільшуються, коли суб’єкти звертаються до тактильного стимулу, але послаблюються, коли суб’єкти відволікаються (Arthurs et al., 2004; Порро та ін., 2004). Крім того, наші пацієнти активували мережу ділянок мозку, відому як мережа позитивних завдань (DeLuca et al., 2006), більше, ніж здорові особи контролю. Ці ділянки мозку активуються під час процесів, які вимагають уваги (Fox et al., 2005; Seminowicz and Davis, 2007). Разом ці висновки свідчать про те, що пацієнти повинні звертати увагу на стимул більше, ніж на контрольну групу, через порушення сенсорного впливу. Ця підвищена увага може також пояснювати підвищену активацію BA1/3b. Звичайно, підвищена активація в BA1/3b також може відображати пластичність, яка не пов’язана з навантаженням на увагу.
 BA2 і S2 обидва отримують проекції від BA1/3b, а також від окремих частин вентропостеріального таламічного комплексу (Pons et al., 1985; Friedman and Murray, 1986). Обидва мозок області мають великі, часто багатозначні (BA2) або двосторонні (S2) рецептивні поля (Pons et al., 1985; Iwamura et al., 2002). На основі анатомічних проекцій та властивостей нейронної реакції було продемонстровано ієрархічну обробку тактильної інформації від BA1/3b до BA 2 (Kaas et al., 2002). Крім того, електрофізіологічні дослідження на макак (Pons et al., 1987) та дані магнітоенцефалографії, отримані у людей, свідчать про те, що послідовна обробка тактильних вхідних даних відбувається від S1 до S2 у вищих приматів (Frot and Mauguiere 1999; Disbrow et al. ., 2001). Кілька досліджень продемонстрували, що BA2 переважно активується формою та кривизною (Bodegard et al., 2001), тоді як S2 може брати участь у тактильному навчанні (Ridley and Ettlinger 1976; Murray and Mishkin, 1984), підтверджуючи думку, що ці ділянки мозку беруть участь у соматосенсорній обробці вищого порядку. Наша психофізична оцінка продемонструвала, що пацієнти були значно погіршені при виявленні простих тактильних подразників і в тесті на визначення текстури форми через 1.5 роки після операції (Taylor et al., 2008a). Цей останній тест оцінює здатність пацієнта розпізнавати характеристики об’єкта під час активного дослідження форми або текстури, що вимагає інтеграції сенсорної інформації в різних областях тіла (Rosen and Lundborg, 1998). Взято разом, одна інтерпретація наших даних полягає в тому, що пацієнти з PNIr більше звертають увагу на вібротактильний стимул, що призводить до посилення активації позитивної мережі та BA1/3. Однак у цих пацієнтів наші дані свідчать про те, що області обробки вищого порядку, такі як BA2 і S2, не отримували тактильну інформацію, що, у свою чергу, може призвести до витончення кори і зниження реакцій BOLD.
BA2 і S2 обидва отримують проекції від BA1/3b, а також від окремих частин вентропостеріального таламічного комплексу (Pons et al., 1985; Friedman and Murray, 1986). Обидва мозок області мають великі, часто багатозначні (BA2) або двосторонні (S2) рецептивні поля (Pons et al., 1985; Iwamura et al., 2002). На основі анатомічних проекцій та властивостей нейронної реакції було продемонстровано ієрархічну обробку тактильної інформації від BA1/3b до BA 2 (Kaas et al., 2002). Крім того, електрофізіологічні дослідження на макак (Pons et al., 1987) та дані магнітоенцефалографії, отримані у людей, свідчать про те, що послідовна обробка тактильних вхідних даних відбувається від S1 до S2 у вищих приматів (Frot and Mauguiere 1999; Disbrow et al. ., 2001). Кілька досліджень продемонстрували, що BA2 переважно активується формою та кривизною (Bodegard et al., 2001), тоді як S2 може брати участь у тактильному навчанні (Ridley and Ettlinger 1976; Murray and Mishkin, 1984), підтверджуючи думку, що ці ділянки мозку беруть участь у соматосенсорній обробці вищого порядку. Наша психофізична оцінка продемонструвала, що пацієнти були значно погіршені при виявленні простих тактильних подразників і в тесті на визначення текстури форми через 1.5 роки після операції (Taylor et al., 2008a). Цей останній тест оцінює здатність пацієнта розпізнавати характеристики об’єкта під час активного дослідження форми або текстури, що вимагає інтеграції сенсорної інформації в різних областях тіла (Rosen and Lundborg, 1998). Взято разом, одна інтерпретація наших даних полягає в тому, що пацієнти з PNIr більше звертають увагу на вібротактильний стимул, що призводить до посилення активації позитивної мережі та BA1/3. Однак у цих пацієнтів наші дані свідчать про те, що області обробки вищого порядку, такі як BA2 і S2, не отримували тактильну інформацію, що, у свою чергу, може призвести до витончення кори і зниження реакцій BOLD.
Вважається, що острівець відіграє важливу роль в інтеграції мультимодальної інформації, важливої для сенсомоторних, емоційних, алостатичних/гомеостатичних і когнітивних функцій (Devinsky et al., 1995; Critchley, 2004; Craig, 2008) і була позначена як лімбічна сенсорна кора (Craig). , 2008). У кількох дослідженнях повідомлялося про активацію острівців у відповідь на тактильну стимуляцію (Gelnar et al., 1998;
Доунар та ін., 2002) та анатомічні дослідження у приматів продемонстрували, що острівка взаємно пов’язана з лобовою, тім’яною та скроневою частками (Augustine, 1996). У наших пацієнтів правий передній острівець був єдиною ділянкою кори, яка продемонструвала значне витончення кори в поєднанні зі зниженими значеннями фракційної анізотропії в сусідній білій речовині, що свідчить про те, що витончення кори в цій області пов’язане з втратою волокон, що виступають до або з цю структуру. Права передня острівка була залучена до інтероцепції, оскільки вона розташована для інтеграції гомеостатичного введення організму з мотиваційними, емоційними та соціальними умовами (Craig, 2008). Крім того, Critchley et al. (2004) повідомили про кореляцію між інтероцептивними здібностями та об’ємом сірої речовини правої передньої острівці. Враховуючи наше відкриття, що у пацієнтів зменшилася сіра речовина в правій передній острівці, було б цікаво оцінити інтероцептивні можливості після травми периферичного нерва в майбутньому дослідженні.
У сукупності ми вперше продемонстрували, що функціональні та структурні зміни присутні в корі головного мозку людини через 1.5 роки після повного перетину периферичного нерва верхньої кінцівки, який був відремонтований мікрохірургічним шляхом. Крім того, вимірювання нервової провідності вказують на неповну периферичну регенерацію у цих пацієнтів. Крім того, ми показуємо, що товщина кори пов’язана з психофізичними заходами відновлення, оскільки більш тонка кора в межах BA2 і S2 була пов’язана з погіршенням соматосенсорної функції. Ці дані свідчать про те, що відновлення нормальних функціональних карт активації безпосередньо пов’язане з успішною регенерацією периферичних аферентів.
Кері С. Тейлор, 1,2 Дімітрі Дж. Анастакіс2,3,4 та Карен Д. Девіс1,2,3
1 Відділ мозку, візуалізації та поведінки – системної нейронауки, Західний дослідницький інститут Торонто, Мережа охорони здоров’я університету, Торонто, Канада M5T258
2 Інститут медичних наук Університету Торонто, Канада
3 кафедра хірургії, Університет Торонто, Канада
4 Ресурсний центр клінічних досліджень, Західний дослідницький інститут Торонто, Університетська мережа охорони здоров'я, Торонто, Канада M5T2S8
Листування: Карен Д. Девіс, д.т.н.,
Відділ мозку, зображень та поведінки – системної нейронауки, Західний дослідницький інститут Торонто,
Західна лікарня Торонто,
Університетська мережа охорони здоров'я,
Кімната MP14-306, 399 Bathurst Street,
Торонто, Онтаріо,
Канада M5T 2S8
Електронна пошта: kdavis@uhnres.utoronto.ca
Подяки
Автори дякують пану Джеффу Поупу, доктору Адріану Кроулі, пану Юджину Хласні та пану Кіту Та за експертну технічну допомогу. Автори висловлюють подяку доктору Пітеру Ешбі та пану Фредді Пейзу з клініки EMG Western Hospital Торонто за проведення тестів на нервову провідність та за експертну оцінку результатів. Автори також дякують докторам Двалі, Бінхаммеру, Фіалкову та Антонишину за співпрацю з цим проектом. Д-р Девіс є канадським дослідником у галузі мозку та поведінки (CIHR MOP 53304).
Фінансування
The Physicians’ Services Incorporated та спільний грант від Центру вивчення болю Університету Торонто/AstraZeneca.
Додатковий матеріал
Додатковий матеріал доступний на сайті Brain online.
порожній
Список використаної літератури:
Апкарян А.В., Соса Ю., Сонті С. та ін. Хронічний біль у спині пов’язаний з
зниження щільності сірої речовини префронтальної та таламічної частини. J Neurosci
2004; 24: 10410�5.
Артурс О. Дж., Йогансен-Берг Х, Метьюз П. М., Боніфацій С. Дж. Увага
диференційно модулює зчеплення фМРТ BOLD і викликаного
амплітуди потенціалу сигналу в соматосенсорній корі людини 7.
Exp Brain Res 2004; 157: 269.
Августин молодший Схема і функціональні аспекти острівної частки
у приматів, включаючи людей. Brain Res Brain Res Rev 1996; 22:
229�44.
Beaulieu C. Основи анізотропної дифузії води в нервовій системі
система – технічний огляд. ЯМР Biomed 2002; 15: 435.
Бодегард А, Гейєр С, Грефкес С, Зіллес К, Роланд П.Е. Ієрархічний
обробка тактильної форми в мозку людини. Neuron 2001; 31:
317�28.
Крейг AD. Інтероцепція та емоції: нейроанатомічна перспектива.
В: Льюїс М., Хевіленд-Джонс Дж., Баррет Л., редактори. Довідник з
емоції. Нью-Йорк: Guildford Press; 2008. с. 272�87.
Кричлі HD. Кора людини реагує на інтероцептивний виклик.
Proc Natl Acad Sci США 2004; 101: 6333�4.
Крітчлі HD, Вінс С., Ротштейн П., Оман А., Долан Р.Д. Нейронні системи
підтримка інтероцептивного усвідомлення. Nat Neurosci 2004; 7: 189.
Дейл А.М., Фішль Б., Серено М.І. Кортикальний поверхневий аналіз. І. Сегментація
і реконструкція поверхні. Neuroimage 1999; 9: 179.
Davis KD, Pope G, Chen J, Kwan CL, Crawley AP, Diamant NE. Коркова
витончення при СРК: наслідки для гомеостатики, уваги та болю
обробка. Неврологія 2008; 70: 153�4.
ДеЛука М., Бекманн К.Ф., Де С.Н., Метьюз П.М., Сміт С.М. фМРТ у спокої
мережі станів визначають різні режими міжміських взаємодій
в мозку людини. Neuroimage 2006; 29: 1359�67.
Девінський О., Моррелл М.Дж., Фогт Б.А. Вклади передньої поясної частини
кора до поведінки. Мозок 1995; 118 (Pt 1): 279�306.
Disbrow E, Roberts T, Poeppel D, Krubitzer L. Докази міжпівкульних
обробка введених даних з рук у S2 людини
і PV. J Neurophysiol 2001; 85: 2236�44.
Даунар Дж., Кроулі А.П., Мікуліс Діджей, Девіс К.Д. Коркова мережа чутлива
щоб стимулювати помітність у нейтральному поведінковому контексті в кількох
сенсорні модальності. J Neurophysiology 2002; 87: 615.
Драганскі Б., Мозер Т., Люммель Н. та ін. Зменшення сірого таламуса
захворювання після ампутації кінцівки. Neuroimage 2006; 31: 951�7.
Фішль Б, Дейл А.М. Вимірювання товщини кори головного мозку людини
з магнітно-резонансних зображень. Proc Natl Acad Sci США 2000; 97:
11050�5.
Фішль Б., Серено М.І., Дейл А.М. Кортикальний поверхневий аналіз. II:
Роздування, сплощення та система координат на основі поверхні.
Neuroimage 1999a; 9: 195�207.
Фішл Б., Серено М.І., Тутелл Р.Б., Дейл А.М. Міжпредметні з високою роздільною здатністю
усереднення і система координат для поверхні кори. Hum Brain
Map 1999b; 8: 272�84.
Флоренс С.Л., Каас Дж.Х. Масштабна реорганізація на кількох рівнях
соматосенсорний шлях йде після терапевтичної ампутації кисті
у мавп. J Neurosci 1995; 15: 8083�95.
Фокс MD, Снайдер AZ, Вінсент JL, Corbetta M, Van E, Raichle ME. The
людський мозок внутрішньо організований у динамічні, антикорельовані
функціональні мережі. Proc Natl Acad Sci США 2005; 102: 9673�9678.
Фрідман DP, Мюррей EA. Таламічна зв'язність другого
соматосенсорна область і сусідні соматосенсорні поля
бічна борозна макаки. J Comp Neurol 1986; 252: 348�73.
Frot M, Mauguiere F. Час і просторовий розподіл соматосенсорних
відповіді, записані у верхньому березі сильвієвої щілини (область SII) в
людей. Кора головного мозку 1999; 9: 854�63.
Geha PY, Baliki MN, Harden RN, Bauer WR, Parrish TB, Apkarian AV.
Мозок при хронічному CRPS болю: аномальна сіро-біла речовина
взаємодії в емоційній та вегетативній областях. Нейрон 2008; 60:
570�81.
Гельнар П.А., Краусс Б.Р., Северений Н.М., Апкарян А.В. Представлення кінчиків пальців
в соматосенсорній корі людини: дослідження фМРТ.
Neuroimage 1998; 7: 261.
Хікмотт П.В., Стін П.А. Масштабні зміни дендритної структури
під час реорганізації соматосенсорної кори дорослих. Nat Neurosci
2005; 8: 140�42.
Iwamura Y, Tanaka M, Iriki A, Taoka M, Toda T. Обробка
тактильні та кінестетичні сигнали з двосторонніх сторін тіла в
постцентральна звивина неспанних мавп. Behav Brain Res 2002; 135:
185�90.
Jaquet JB, Luijsterburg AJ, Kalmijn S, Kuypers PD, Hofman A, Hovius SE.
Ураження серединного, ліктьового та комбінованого серединно-ліктьового нервів: функціональні
результат і повернення до продуктивності. J Trauma 2001; 51: 687.
Юркевич MT, Кроулі AP, Verrier MC, Fehlings MG, Мікуліс DJ.
Соматосенсорна кортикальна атрофія після травми спинного мозку: воксельна
вивчення морфометрії. Неврологія 2006; 66: 762�4.
Каас Дж.Х. Пластичність сенсорно-моторних карт у дорослих ссавців. Анну
Rev Neurosci 1991; 14: 137�67.
Каас JH, Jain N, Qi HX. Організація соматосенсорної системи в
примати. В: Nelson RJ, редактор. Соматосенсорна система.
Вашингтон, округ Колумбія: CRC Press; 2002. с. 1�25.
Кімура Дж. Електродіагностика при захворюваннях нервів і м'язів: принципи
і практика. Оксфорд: Oxford University Press; 2001 рік.
Кімура Дж. Принципи та підводні камені дослідження нервової провідності. Енн Нейрол
1984; 16: 415�29.
Knyihar-Csillik E, Rakic P, Csillik B. Транснейронна дегенерація в
речовина Роландо спинного мозку приматів, викликане
Спричинена аксотомією трансгангліонарна дегенеративна атрофія центральної
первинні сенсорні термінали. Cell Tissue Res 1989; 258: 515�25.
Liss AG, af Ekenstam FW, Wiberg M. Втрата нейронів у дорсальному корінці
ганглії після перетину периферичного чутливого нерва. Анатомічний
вивчення на мавпах. Scand J Plast Reconstr Surg Hand Surg 1996; 30: 1�6.
Lotze M, Flor H, Grodd W, Larbig W, Birbaumer N. Phantom moves
і біль. ФМРТ дослідження у ампутованих верхніх кінцівок. Мозок 2001;
124: 2268�77.
Manduch M, Bezuhly M, Anastakis DJ, Crawley AP, Mikulis DJ. Серійний
ФМРТ адаптивних змін первинної сенсомоторної кори наступного
реконструкція великого пальця. Неврологія 2002; 59: 1278�81.
Май А. Хронічний біль може змінити структуру мозку. Біль 2008;
137: 7�15.
Макаллістер Р. М., Гілберт С. Е., Колдер Дж. С., Сміт П. Дж. Епідеміологія і
лікування ушкоджень периферичних нервів верхніх кінцівок у сучасних
практика. J Hand Surg (Br) 1996; 21: 4:13.
Мюррей Е.А., Мішкін М. Відносний внесок SII і площі5 в тактильність
дискримінація у мавп 2. Behav Brain Res 1984; 11: 67�83.
Нападов В., Кеттнер Н., Райан А., Квонг К.К., Одетт Дж., Хуї К.К.
Соматосенсорна кортикальна пластика при тунельному синдромі зап'ястя - поперечний зріз
фМРТ оцінка. Neuroimage 2006; 31: 520.
Oldfield RC. Оцінка та аналіз рукою: Единбург
інвентаризація. Neuropsychologia 1971; 9: 97�113.
Pons TP, Garraghty PE, Cusick CG, Kaas JH. Соматотопна організація
площі 2 у мавп макак 6. J Comp Neurol 1985; 241: 445�66.
Понс Т.П., Гарраті П.Е., Фрідман Д.П., Мішкін М. Фізіологічні докази
для серійної обробки в соматосенсорній корі. Наука 1987; 237:
417�20.
Porro CA, Lui F, Facchin P, Maieron M, Baraldi P. Активність, пов’язана з сприйняттям
в соматосенсорній системі людини: функціональний магнітний резонанс
дослідження зображень. Magn Reson Imaging 2004; 22: 1539�48.
Пауелл Т. П., Ерулкар С. Транснейрональна клітинна дегенерація в слуховому відділі
релейні ядра кат. Й Анат 1962; 96: 249�68.
Рідлі Р.М., Еттлінгер Г. Порушення тактильного навчання та утримання після
видалення другої соматичної сенсорної проекційної кори (SII) в
мавпа. Brain Res 1976; 109: 656.
Розен Б., Лундборг Г. Новий інструмент тактильного гнозису в чутливості
тестування. J Hand The 1998; 11: 251�7.
Семінович Д.А., Девіс К.Д. Біль посилює функціональну зв’язок
мозкової мережі, викликаної виконанням когнітивного завдання.
J Neurophysiol 2007; 97: 3651�9.
Smith SM, Jenkinson M, Johansen-Berg H та ін. На основі урочища просторові
статистика: воксельний аналіз даних багатопредметної дифузії.
Neuroimage 2006; 31: 1487.
Talairach J, Tournoux P. Копланарний стереотаксичний атлас людського мозку.
Нью-Йорк: Thieme Medical Publishers Inc.; 1988 рік.
Тейлор К.С., Анастакіс Діджей, Девіс К.Д. Хронічний біль після периферичного
пошкодження нерва пов'язане з катастрофічністю болю і невротизмом.
Int Ass Stud Pain 2008a; 267.
Тейлор К.С., Девіс К.Д. Стабільність тактильного та больового фМРТ
активації мозку: дослідження порогово-залежних і
незалежні від порогу методи. Hum Brain Mapp 2009; 30:
1947�62.
Тейлор К.С., Семінович Д.А., Девіс К.Д. Дві системи стану спокою
зв'язок між острівцем і поясною корою. Hum Brain
Карта 2008b;DOI:10.1002/hbm.20705.
Wall JT, Kaas JH, Sur M, Nelson RJ, Felleman DJ, Merzenich MM.
Функціональна перебудова в соматосенсорних ділянках кори 3b і 1
дорослих мавп після відновлення серединного нерва: можливе відношення до
відновлення чутливості у людини. J Neurosci 1986; 6: 218�33.
Закрити акордеон
Інформація в цьому документі на "Перерізання нерва змінює ваш мозок | Ель-Пасо, Техас." не призначений для заміни особистих стосунків із кваліфікованим медичним працівником або ліцензованим лікарем і не є медичною консультацією. Ми заохочуємо вас приймати рішення щодо охорони здоров’я на основі ваших досліджень і партнерства з кваліфікованим медичним працівником.
Інформація в блозі та обговорення обсягу
Наша інформаційна сфера обмежується хіропрактикою, опорно-руховим апаратом, фізичними препаратами, оздоровленням, що сприяє етіологічному вісцеросоматичні порушення у клінічних презентаціях, клінічній динаміці асоційованого соматовісцерального рефлексу, комплексах підвивиху, чутливих питаннях здоров’я та/або статей, темах та дискусіях з функціональної медицини.
Надаємо та презентуємо клінічне співробітництво з фахівцями різних галузей. Кожен фахівець керується своєю професійною сферою практики та юрисдикцією ліцензування. Ми використовуємо протоколи функціонального здоров’я та оздоровлення для лікування та підтримки догляду за травмами або розладами опорно-рухового апарату.
Наші відео, дописи, теми, предмети та висновки охоплюють клінічні питання, проблеми та теми, які стосуються та прямо чи опосередковано підтримують нашу клінічну практику.*
Наш офіс обґрунтовано намагався надати підтверджувальні цитати та визначив відповідне дослідження або дослідження, що підтверджують наші публікації. За запитом ми надаємо копії допоміжних наукових досліджень, доступні регуляторним комісіям та громадськості.
Ми розуміємо, що ми розглядаємо питання, які потребують додаткового пояснення того, як це може допомогти в певному плані догляду або протоколі лікування; тому для подальшого обговорення вищезазначеної теми, будь ласка, не соромтеся запитувати Доктор Алекс Хіменес, округ Колумбія, Або зв'яжіться з нами за адресою 915-850-0900.
Ми тут, щоб допомогти вам та вашій родині.
Благословення
Д-р Алекс Хіменес Постійного струму, MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
електронна пошта: coach@elpasofunctionalmedicine.com
Ліцензія доктора хіропрактики (DC) у Техас & Нью-Мексико*
Техас, округ Колумбія, номер ліцензії TX5807, Нью-Мексико, округ Колумбія Номер ліцензії NM-DC2182
Ліцензія дипломованої медсестри (RN*) in Флорида
Ліцензія Флориди Ліцензія RN # RN9617241 (Контрольний номер 3558029)
Компактний статус: Мультидержавна ліцензія: Уповноважений на практику в Стани 40*
Доктор Алекс Хіменес, округ Колумбія, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Моя цифрова візитна картка