Алессіо Ненсіоні, Ірен Каффа, Сальваторе Кортелліно
Анотація | Уразливість ракових клітин до нестачі поживних речовин та їхня залежність від конкретних метаболітів є ознаками раку. Голодування або дієти, що імітують голодування (FMDs) призводять до значних змін у факторах росту та рівнях метаболітів, створюючи середовище, яке може зменшити здатність ракових клітин адаптуватися та виживати, і таким чином покращуючи ефекти лікування раку. Крім того, голодування або ящур підвищують стійкість до хіміотерапії у нормальних, але не ракових клітин, і сприяють регенерації в нормальних тканинах, що може допомогти запобігти шкідливим і потенційно небезпечним для життя побічним ефектам лікування. Хоча пацієнти погано переносять голодування, як дослідження на тваринах, так і клінічні дослідження показують, що цикли низькокалорійних ящурів є здійсненними та в цілому безпечними. Кілька клінічних випробувань, які оцінюють вплив голодування або ящуру на побічні явища, що виникли при лікуванні, та на результати ефективності тривають. Ми вважаємо, що комбінація ящуру з хіміотерапією, імунотерапією або іншими методами лікування є потенційно перспективною стратегією для підвищення ефективності лікування, запобігання придбання резистентності та зменшення побічних ефектів.
Фактори харчування та способу життя є ключовими факторами, що визначають ризик розвитку раку, при цьому деякі види раку більше залежать від харчових звичок, ніж інші1�
Незважаючи на те, що за останнє десятиліття ми стали свідками безпрецедентних змін і помітних успіхів у лікуванні раку14,15, залишається вкрай необхідна більш ефективна і, можливо,
Голодування змушує здорові клітини перейти до повільного поділу та високозахищеного режиму, який захищає їх від токсичних впливів протипухлинних препаратів, одночасно сенсибілізуючи різні типи ракових клітин до цих терапевтичних засобів11,12,17. Це відкриття означає, що одне дієтичне втручання потенційно може допомогти вирішити різні і однаково важливі аспекти лікування раку.
У цій статті Opinion ми обговорюємо біологічне обґрунтування використання голодування або дієт, що імітують голодування (FMDs), щоб притупити TEAE, а також для запобігання та лікування раку. Ми також ілюструємо застереження цього експериментального підходу18,19 та опублікованих та поточних клінічних досліджень, у яких голодування або ящур застосовувалися до пацієнтів з раком.
зміст
Системна та клітинна реакція на голодування
Голодування призводить до змін у активності багатьох метаболічних шляхів, пов’язаних із перемиканням у режим, здатний генерувати енергію та метаболіти з використанням джерел вуглецю, що вивільняються переважно з жирової тканини та частково з м’язів. Зміни в рівнях циркулюючих гормонів і метаболітів призводять до зменшення поділу клітин і метаболічна активність нормальних клітин і в кінцевому підсумку захищає їх від хіміотерапевтичних ушкоджень11,12. Ракові клітини, порушуючи накази проти росту, продиктовані цими умовами голодування, можуть мати протилежну реакцію нормальних клітин і, отже, стати чутливими до хіміотерапії та інших методів лікування раку.
Системна реакція на голодування
Реакція на голодування частково визначається рівнем глюкози, інсуліну, глюкагону, гормону росту (GH), IGF1, глюкокортикоїдів.
Глюкагон і низький рівень інсуліну також стимулюють розпад тригліцеридів (які в основному зберігаються в жировій тканині) на гліцерин і вільні жирні кислоти. Під час голодування більшість тканин використовує жирні кислоти для отримання енергії, тоді як мозок покладається на глюкозу та кетонові тіла, що виробляються гепатоцитами (кетонові тіла можуть вироблятися з ацетил-КоА, що утворюється в результаті ?-окислення жирних кислот або з кетогенних амінокислот). У кетогенній фазі голодування кетонові тіла досягають концентрації в мілімолярному діапазоні, зазвичай починаючи через 2 дні від початку голодування. Разом з гліцерином та амінокислотами, отриманими з жиру, кетонові тіла підтримують глюконеогенез, який підтримує рівень глюкози в концентрації приблизно 3 мМ (4 мг на дл), яка в основному використовується мозком.
Глюкокортикоїди та адреналін також сприяють направлянню метаболічних адаптацій до
Нарешті, голодування знижує рівень циркулюючого лептину, гормону, що виробляється переважно адипоцитами, який пригнічує відчуття голоду, одночасно збільшуючи рівень адипонектину, який збільшує розпад жирних кислот23,24. Таким чином, у висновку, характерними ознаками системної реакції ссавців на голодування є низький рівень глюкози та інсуліну, високий рівень глюкагону та кетонових тіл, низький рівень IGF1 та лептину та високий рівень адипонектину.
Реакція клітин на голодування
Реакція здорових клітин на голодування еволюційно зберігається і забезпечує захист клітин, і, принаймні, у модельних організмів, як було показано, збільшує тривалість життя та здоров’я12,22,25. IGF31
Голодування та пов’язане з цим обмеження глюкози пригнічують активність PKA, підвищують активність AMPK та активують EGR1 і, таким чином, досягають захисних ефектів клітин, у тому числі в міокарді22,25,26. Нарешті, голодування та ящур (їх склад див. нижче) також мають здатність сприяти регенеративним ефектам (Вставка 1) за допомогою молекулярних механізмів, деякі з яких були причетні до раку, наприклад, збільшення аутофагії або індукції активності сиртуїну22,37�49 .

Дієтичні підходи при ящурах раку
Дієтичні підходи, засновані на голодуванні, які були більш детально досліджені в онкології, як доклінічно, так і клінічно, включають водне голодування (утримання від будь-якої їжі та напоїв, крім води) та ящуру11,12,17,25,26,50 (табл. 60). Попередні клінічні дані вказують на те, що для досягнення клінічно значущих ефектів в онкології може знадобитися голодування тривалістю принаймні 1 годин, наприклад, запобігання пошкодженню ДНК здорових тканин, викликаному хіміотерапією, і допомога в підтримці
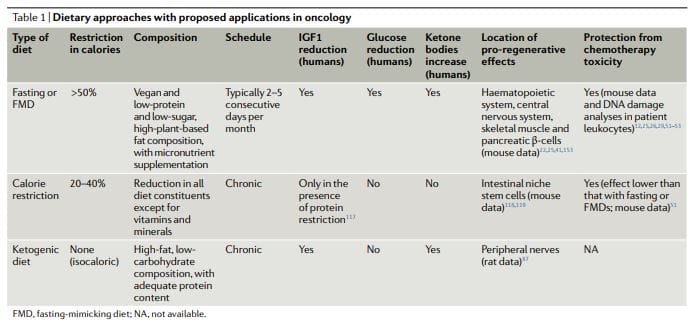
Однак більшість пацієнтів відмовляються або мають труднощі з дотриманням водного голодування, і потенційний ризик дефіциту калорій і мікроелементів, пов’язаного з цим, важко виправдати. Ящур — це розроблені медичними методами дієтичні режими з дуже низьким вмістом калорій (тобто, як правило, від 300 до 1,100 ккал на день), цукру та білків, які відтворюють багато ефектів голодування лише на воді, але з кращим дотриманням пацієнтом і зниженим ризиком харчування22,61,62, 3 Під час ящуру пацієнти зазвичай отримують необмежену кількість води, невеликі стандартні порції овочевих бульйонів, супів, соків, горіхових батончиків і трав’яних чаїв, а також мікроелементів. У клінічному дослідженні 5-х місячних циклів 1-денного ящуру у загалом здорових добровольців дієта добре переносилася і зменшувала тулуб і загальний жир, кров’яний тиск і рівні IGF62. У попередніх і поточних онкологічних клінічних дослідженнях натщесерце або ящур зазвичай призначали кожні 3 тижні, наприклад, у поєднанні зі схемами хіміотерапії, і їх тривалість коливалася від 4 до 1 днів5 . Важливо, що жодних серйозних побічних явищ (рівень G52,53,58,61,63 або вище, згідно з загальними термінологічними критеріями для побічних явищ) не повідомлялося в цих дослідженнях68.
Кетогенні дієти
Кетогенні дієти (КД) – це режими харчування, які мають нормальну калорійність, високий вміст жирів і низький вміст вуглеводів69,70. У класичній КД співвідношення між масою жиру та загальною масою вуглеводів і білків становить 4:1. Слід зазначити, що ящури також є кетогенними, оскільки вони мають високий вміст жирів і здатні викликати значне підвищення (≥0.5 ммоль на літр) рівня циркулюючих кетонових тіл. У людей КД також може знижувати рівні IGF1 та інсуліну (більш ніж на 20% від вихідних значень), хоча на ці ефекти впливають рівні та типи вуглеводів і білка в дієті71. КД можуть знижувати рівень глюкози в крові, але зазвичай вони залишаються в межах норми (тобто >4.4 ммоль на літр)71.
Примітно, що KD можуть бути ефективними для запобігання підвищення рівня глюкози та інсуліну, яке зазвичай виникає у відповідь на інгібітори PI3K, що, як було запропоновано, обмежує їх ефективність72. Традиційно КД використовували для лікування рефрактерної епілепсії, переважно у дітей69. На моделях мишей KD викликають протиракові ефекти, особливо при гліобластомі70,72. Клінічні дослідження вказують на те, що КД, ймовірно, не мають значної терапевтичної активності при застосуванні в якості окремого засобу у пацієнтів з раком, і припускають, що потенційні переваги цих дієт слід шукати в поєднанні з іншими підходами, такими як хіміотерапія, променева терапія, антиангіогенне лікування, інгібітори PI86K.
Повідомлялося, що КД мають нейропротекторну дію на периферичні нерви та гіпокамп87,88. Однак залишається встановити, чи мають KD також прорегенеративну дію, подібну до голодування або ящуру (вставка 1), і чи можна також використовувати KD для захисту живих ссавців від токсичності хіміотерапії. Примітно, що регенеративні ефекти голодування або ящуру, мабуть, максимізуються за рахунок перемикання з режиму реагування на голодування, який включає розпад клітинних компонентів і загибель багатьох клітин, а також період повторного харчування, під час якого клітини і тканини зазнають реконструкція22. Оскільки КД не примушують перейти в режим голодування, не сприяють значному розпаду внутрішньоклітинних компонентів і тканин і не включають період повторного годування, вони навряд чи викличуть тип скоординованої регенерації, який спостерігається під час повторного годування ящуру.
Обмеження калорійності
Хоча хронічне обмеження калорій (CR) і дієти з дефіцитом специфічних амінокислот сильно відрізняються від періодичного голодування, вони поділяють з голодуванням і ящурами більш-менш селективне обмеження поживних речовин, і вони мають протипухлинний ефект81,89. CR зазвичай включає хронічне зниження споживання енергії на 112% порівняно зі стандартним споживанням калорій, що дозволить людині підтримувати нормальну вагу20. Він дуже ефективний для зниження серцево-судинних факторів ризику та захворюваності на рак у модельних організмів, включаючи приматів30.
Однак CR може викликати побічні ефекти, такі як зміни зовнішнього вигляду, підвищена чутливість до холоду, зниження сили, порушення менструального циклу, безпліддя, втрата лібідо, остеопороз, повільне загоєння ран, нав’язлива думка, дратівливість і депресія. У пацієнтів з раком є серйозні побоювання, що це може посилити недоїдання і що це неминуче призведе до надмірної втрати м’язової маси тіла18,113. CR знижує рівень глюкози в крові натще, хоча вони залишаються в межах норми116. У людей хронічний CR не впливає на рівень IGF114, якщо також не реалізовано помірне обмеження білка1.
Дослідження показують, що, зменшуючи передачу сигналів mTORC1 в клітинах Панета, CR посилює їх функцію стовбурових клітин і що він також захищає резервні стовбурові клітини кишечника від пошкодження ДНК118,119, але невідомо, чи CR також викликає прорегенеративні ефекти в інших органах. Таким чином, наявні дані свідчать про те, що голодування та ящур створюють метаболічний, регенеративний та захисний профіль, який є відмінним і, ймовірно, більш потужним, ніж той, що викликається KD або CR.
Голодування та ящур в терапії: вплив на рівень гормонів і метаболітів
Багато змін у рівнях циркулюючих гормонів і метаболітів, які зазвичай спостерігаються у відповідь на голодування, мають здатність виявляти протипухлинну дію (тобто знижувати рівень глюкози, IGF1, інсуліну та лептину та підвищувати рівні адипонектину)23,120,121 та/ або для захисту здорових тканин від побічних ефектів (тобто зниження рівня IGF1 і глюкози). Оскільки кетонові тіла можуть інгібувати гістондеацетилазу (HDAC), збільшення кетонових тіл, викликане голодуванням, може сприяти уповільненню росту пухлини та сприяти диференціації через епігенетичні механізми122.
Проте було показано, що ацетоацетат кетонового тіла прискорює, а не зменшує ріст деяких пухлин, таких як меланома з мутованим BRAF123. Ті зміни, щодо яких є найсильніші докази ролі в сприятливих ефектах голодування та ящуру проти раку, — це зниження рівня IGF1 та глюкози. На молекулярному рівні голодування або ящур зменшують внутрішньоклітинні каскади сигналів, включаючи передачу сигналів IGF1R�AKT�mTOR�S6K і cAMP�PKA, збільшують аутофагію, допомагають нормальним клітинам протистояти стресу і сприяють протипухлинному імунітету25,29,56,124
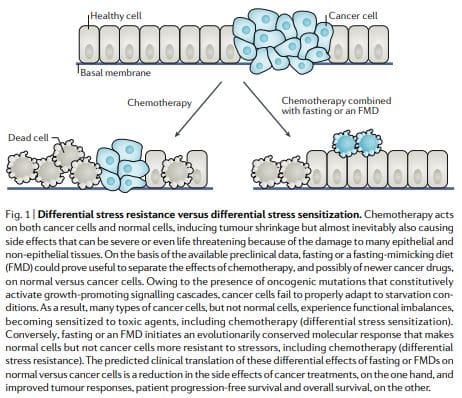
Диференційна стресостійкість: підвищення переносимості хіміотерапії
Деякі ортологи онкогену дріжджів, такі як Ras і Sch9 (функціональний ортолог S6K ссавців), здатні знижувати стійкість до стресу в модельних організмах27,28. Крім того, мутації, які активують IGF1R, RAS, PI3KCA або AKT, або інактивують PTEN, присутні в більшості випадків раку людини10. Разом це призвело до гіпотези про те, що голодування спричинить протилежні ефекти у ракових порівняно з нормальними клітинами з точки зору їхньої здатності протистояти клітинним стресовим факторам, включаючи хіміотерапевтичні засоби. Іншими словами, голодування може призвести до
Відповідно до гіпотези DSR, нормальні клітини реагують на голодування шляхом зниження регуляції проліферації, пов’язаної з генезом рибосом та/або складання генів, що змушує клітини переходити в режим самообслуговування та захищає їх від пошкоджень, викликаних хіміотерапією, радіотерапією та іншими токсичними агентами. Навпаки, в ракових клітинах цей режим самопідтримки попереджається через онкогенні зміни, які викликають конститутивне гальмування шляхів реакції на стрес12 (рис. 1). Відповідно до моделі DSR, короткочасне голодування або видалення протоонкогену
Подібні результати були отримані на клітинах ссавців: вплив середовища з низьким вмістом глюкози захищало первинні клітини глії миші від токсичності перекису водню або циклофосфаміду (прооксидантний хіміотерапевтичний засіб), але не захищало клітинні лінії раку гліоми мишей, щурів і людей нейробластоми. Відповідно до цих спостережень,
Подальші дослідження показали, що знижена передача сигналів IGF1 у відповідь на голодування захищає первинну глію та нейрони, але не клітини гліоми та нейробластоми, від циклофосфаміду та прооксидативних сполук, а також захищає фібробласти ембріонів миші від доксорубіцину29. Миші з дефіцитом IGF1 (LID) у печінці, трансгенні тварини з умовною делецією гена Igf1 у печінці, які демонструють зниження рівня циркулюючого IGF70 на 80% (рівні, подібні до тих, що досягаються при 1-годинному голодуванні у мишей)72, були захищені від три з чотирьох протестованих хіміотерапевтичних препаратів, включаючи доксорубіцин.
Гістологічні дослідження показали ознаки серцевої міопатії, спричиненої доксорубіцином, лише у контрольних мишей, які отримували доксорубіцин, але не у мишей LID. У експериментах з тваринами-носячками меланоми, які отримували доксорубіцин, не спостерігалося різниці в прогресуванні захворювання між контрольними мишами та мишами LID, що вказує на те, що ракові клітини не були захищені від хіміотерапії за рахунок зниження рівня IGF1. Проте, знову ж таки, миші LID з пухлинами показали значну перевагу у виживанні порівняно з контрольними тваринами завдяки їх здатності протистояти токсичності доксорубіцину29. Таким чином, загалом, ці результати підтвердили, що зниження регуляції IGF1 є ключовим механізмом, за допомогою якого голодування підвищує переносимість хіміотерапії.
І дексаметазон, і інгібітори mTOR широко використовуються в лікуванні раку, або через їхню ефективність як протиблювотних засобів і
Ці втручання знижують активність PKA, одночасно збільшуючи активність AMPK і, таким чином, активуючи EGR1, що вказує на те, що сигналізація cAMP� PKA опосередковує DSR, викликану голодуванням через EGR1 (посилання 26). EGR1 також сприяє експресії кардіопротекторних пептидів, таких як передсердний натрійуретичний пептид (ANP) і натрійуретичний пептид B-типу (BNP) в серцевій тканині, що сприяє резистентності до доксорубіцину. Крім того, голодування та/або ящур можуть захистити мишей від кардіоміопатії, спричиненої доксорубіцином, посилюючи аутофагію, що може сприяти здоров’ю клітин за рахунок зменшення виробництва активних форм кисню (ROS) шляхом усунення дисфункціональних мітохондрій та видалення токсичних агрегатів.
На додаток до зниження токсичності, спричиненої хіміотерапією, у клітинах та збільшення виживання мишей, які отримували хіміотерапію, цикли голодування індукують регенерацію кісткового мозку та запобігають імуносупресії, спричиненої циклофосфамідом, пов’язаним із PKA та IGF1 способом25. Таким чином, переконливі доклінічні результати вказують на потенціал голодування та ящуру для підвищення переносимості хіміотерапії та уникнення серйозних побічних ефектів. Оскільки початкові клінічні дані ще більше підтверджують цей потенціал, ці доклінічні дослідження створюють вагоме обґрунтування для оцінки ящуру в рандомізованих клінічних дослідженнях з TEAE як основною кінцевою точкою.
Диференціальна стресова сенсибілізація: збільшення загибелі ракових клітин
Якщо використовувати окремо, більшість дієтичних заходів, включаючи голодування та ящур, мають обмежений вплив на прогресування раку. Відповідно до гіпотези диференційної стресової сенсибілізації (DSS), поєднання голодування або ящуру з другим лікуванням є набагато перспективнішим11,12. Ця гіпотеза передбачає, що, хоча ракові клітини здатні адаптуватися до обмеженої концентрації кисню та поживних речовин, багато типів ракових клітин не здатні виконувати зміни, які б дозволили вижити в дефіциті поживних речовин і токсичному середовищі, створеному комбінацією голодування та хіміотерапії. , наприклад. Ранні експерименти при раку молочної залози, меланомі
Ми вважаємо таку невідповідну реакцію ракових клітин на змінені умови, включаючи зниження рівня IGF1 і глюкози, викликане голодуванням або ящуром, як ключовий механізм, що лежить в основі

Знижуючи доступність глюкози та підвищуючи α-окислення жирних кислот, голодування або ящур також можуть сприяти переходу від аеробного гліколізу (ефект Варбурга) до мітохондріального окисного фосфорилювання в ракових клітинах, що необхідно для підтримки росту ракових клітин у середовищі з найбільшою кількістю поживних речовин50. (рис. 2). Це перемикання призводить до збільшення виробництва АФК11 в результаті підвищеної дихальної активності мітохондрій, а також може включати зниження клітинного окислювально-відновного потенціалу через зниження синтезу глутатіону в результаті гліколізу і пентозофосфатного шляху50. Комбінований ефект збільшення АФК та зниженого антиоксидантного захисту підвищує окислювальний стрес у ракових клітинах та посилює активність хіміопрепаратів. Примітно, що оскільки висока гліколітична активність, продемонстрована високою продукцією лактату, є передвісником агресивності та схильності до метастазування у кількох типів раку129, антиварбургський ефект голодування або ящуру може бути особливо ефективним проти агресивного та метастатичного раку.
Крім зміни метаболізму, голодування або ящур викликають інші зміни, які можуть сприяти DSS в ракових клітинах підшлункової залози. Голодування підвищує рівень експресії
Нарешті, голодування може підвищити регуляцію рецептора лептину та його нижнього рівня
Примітно, що цілком імовірно, що багато типів ракових клітин, включаючи AML29, можуть набути резистентності, обходячи метаболічні зміни, спричинені голодуванням або ящуром, можливість, яка ще більше збільшується через метаболічну гетерогенність, яка характеризує багато видів раку129. Таким чином, головною метою на найближче майбутнє буде виявлення типів раку, які найбільш сприйнятливі до цих дієтичних режимів за допомогою біомаркерів. З іншого боку, у поєднанні зі стандартною терапією голодування або ящур рідко призводили до набуття стійкості на моделях ракових мишей, а стійкість до голодування в поєднанні з хіміотерапією також є рідкісною в дослідженнях in vitro, що підкреслює важливість визначення методів лікування, які: у поєднанні з ящуром, призводять до сильного токсичного впливу на ракові клітини з мінімальною токсичністю для нормальних клітин і тканин11,17,50,55.
Підвищення протипухлинного імунітету голодуванням або ящуром
Останні дані свідчать про те, що голодування або ящур самі по собі і більшою мірою в поєднанні з хіміотерапією викликають розширення лімфоїдних попередників і сприяють
Протиракові дієти в моделях мишей
Загалом, результати доклінічних досліджень голодування або ящуру на моделях раку у тварин, включаючи моделі для метастатичного раку (Таблиця 2), показують, що періодичне голодування або ящур досягають плейотропного протипухлинного ефекту та потенціюють активність хіміопрепаратів та ІТК, надаючи захисний та регенеративний ефект. в багатьох органах22,25. Досягнення тих самих ефектів без голодування та/або ящуру вимагало б спочатку ідентифікації, а потім використання кількох ефективних, дорогих і часто токсичних препаратів, і, ймовірно, було б без переваги стимулювання здорового захисту клітин. Примітно, що принаймні у двох дослідженнях голодування в поєднанні з хіміотерапією виявилося єдиним заходом, здатним досягти або повної регресії пухлини, або довготривалого виживання у стабільної частини тварин, які отримували лікування11,59.
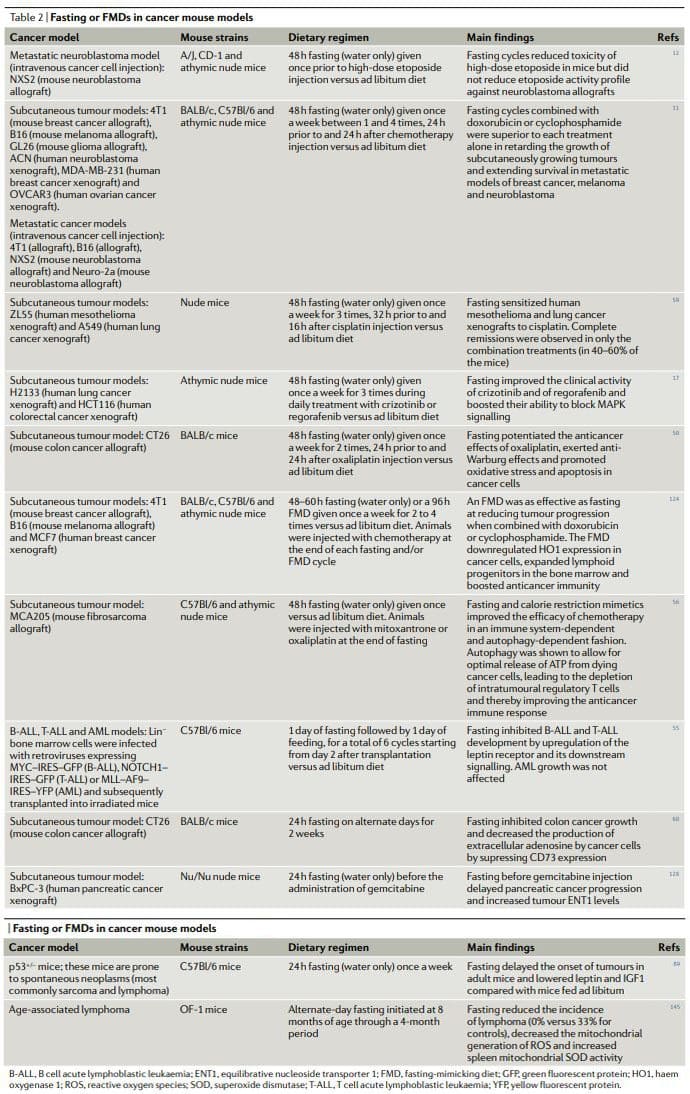
Хронічні КД також показують a
CR зменшив пухлинний генез на моделях генетичного раку миші, моделях мишей зі спонтанним пухлинним генезом та моделях раку миші, індукованого канцерогеном, а також у мавп91,92,97,98,101,102,104�106,108,109,136�138. Навпаки, дослідження показало, що CR від середнього віку насправді збільшує частоту новоутворень плазматичних клітин у мишей C57Bl/6. Однак у тому ж дослідженні CR також подовжив максимальну тривалість життя приблизно на 139%, а спостережуване збільшення захворюваності на рак було пов’язано зі збільшенням тривалості життя мишей, які перенесли CR, віком, у якому
Важливо, що CR покращив активність протипухлинного лікування в кількох моделях раку, включаючи активність антитіла до IGF1R (ганітумабу) проти раку передміхурової залози141, циклофосфаміду проти клітин нейробластоми135 та інгібування аутофагії в ксенотрансплантатах HRAS-G12V-трансформованих клітин безсмертної нирки миші100. Однак CR або KD в поєднанні з протипухлинною терапією, здається, менш ефективні, ніж голодування. Дослідження на мишах показало, що, на відміну від лише голодування, CR сам по собі не зміг зменшити зростання підшкірно зростаючих мишачих гліом GL26 і що, знову ж таки, на відміну від короткочасного голодування, CR не збільшує активність цисплатину проти підшкірної 4T1 молочної залози. пухлини 51. У тому ж дослідженні голодування також виявилося значно ефективнішим, ніж CR та KD, щодо підвищення переносимості доксорубіцину51. Хоча голодування або ящур, CR і KD, ймовірно, діють і модулюють перекриття
Фаза повторного годування могла б
Голодування та ящур у профілактиці раку
Епідеміологічні дослідження та дослідження на тваринах, включаючи мавп108,109,144, і людей підтверджують думку про те, що хронічний CR та періодичне голодування та/або ящур можуть мати профілактичні ефекти у людей. Тим не менш, CR навряд чи може бути реалізований серед населення в цілому через проблеми дотримання та можливі побічні ефекти115. Таким чином, у той час як рекомендації щодо продуктів, які слід віддавати перевагу (або уникати), а також рекомендації щодо способу життя для зниження ризику раку стають створеними6,8,9,15, тепер мета полягає в тому, щоб визначити та, можливо, стандартизувати добре переносимі, періодичні дієти з низьким або відсутністю побічних ефектів та оцінити їх ефективність у профілактиці раку в клінічних дослідженнях.
Як обговорювалося раніше, цикли ящуру викликають зниження регуляції IGF1 і глюкози і підвищення регуляції IGFBP1 і кетонових тіл, які є змінами, подібними до тих, що викликаються самим голодуванням і є біомаркерами реакції на голодування22. Коли миші C57Bl/6 (які спонтанно розвиваються
Попереднє дослідження альтернативного денного голодування, яке проводилося на мишах середнього віку протягом 4 місяців, також виявило, що голодування знижувало захворюваність лімфомою, довівши її з 33% (для контрольних мишей) до 0% (у тих, хто голодував). тварин)145, хоча через коротку тривалість дослідження невідомо, чи цей режим голодування запобігав чи просто сповільнював
Тому багатообіцяючі результати доклінічних досліджень у поєднанні з клінічними даними про вплив ящуру на фактори ризику розвитку
Клінічна застосовність в онкології
Станом на сьогодні опубліковано чотири техніко-економічні дослідження щодо голодування та ящуру у пацієнтів, які проходять хіміотерапію52,53,58,61. У серії випадків із 10 пацієнтів із діагностованими різними типами раку, включаючи рак молочної залози, простати, яєчників, матки, легенів та стравоходу, які добровільно голодували до 140 годин до та/або до 56 годин після хіміотерапії, серйозних побічних ефектів не спричинило. повідомлялося про голодування, крім голоду та запаморочення58. Ті пацієнти (шість), які проходили хіміотерапію натщесерце та без нього, повідомили про значне зниження втоми, слабкості та шлунково-кишкових побічних ефектів під час голодування. Крім того, у тих пацієнтів, у яких можна було оцінити прогресування раку, голодування не запобігало спричиненому хіміотерапією зменшенням об’єму пухлини або онкомаркерам. В іншому дослідженні 13 жінок із HER2 (також відомим як ERBB2) негативним, рак молочної залози II/III стадії, які отримували неоад’ювантну хіміотерапію таксотером, адріаміцином та циклофосфамідом (TAC), були рандомізовані на швидку (лише воду) за 24 години до та після початку хіміотерапії або до харчування відповідно до стандартних рекомендацій52.
Короткочасне голодування добре переносилося і зменшувало зниження середньої кількості еритроцитів і тромбоцитів через 7 днів після хіміотерапії. Цікаво, що в цьому дослідженні рівень ?-H2AX (маркер пошкодження ДНК) підвищувався через 30 хвилин після хіміотерапії в лейкоцитах у пацієнтів, які не голодували, але не у пацієнтів, які голодували. Під час підвищення дози натщесерце у пацієнтів, які проходили хіміотерапію на основі платини, 20 пацієнтів (які в основному лікувались від раку уротелію, яєчників або молочної залози) були рандомізовані на голодування протягом 24, 48 або 72 годин (розділених на 48 годин до хіміотерапії та 24 години після хіміотерапії )53. Критерії доцільності (визначені як три або більше з шести суб'єктів у кожній когорті, які споживали?200 ккал на день протягом періоду голодування без надмірної токсичності) були виконані. Токсичність, пов'язана з голодуванням
Зовсім недавно було проведено рандомізоване перехресне клінічне дослідження, яке оцінювало вплив ящуру на якість життя та побічні ефекти хіміотерапії загалом у 34 пацієнтів з раком молочної залози або яєчників61. Ящур складався з
Проблеми в клініці
Вивчення періодичного голодування або ящуру в онкології не позбавлене занепокоєння, особливо щодо можливості того, що цей тип дієтичного режиму може спричинити недоїдання, саркопенію,
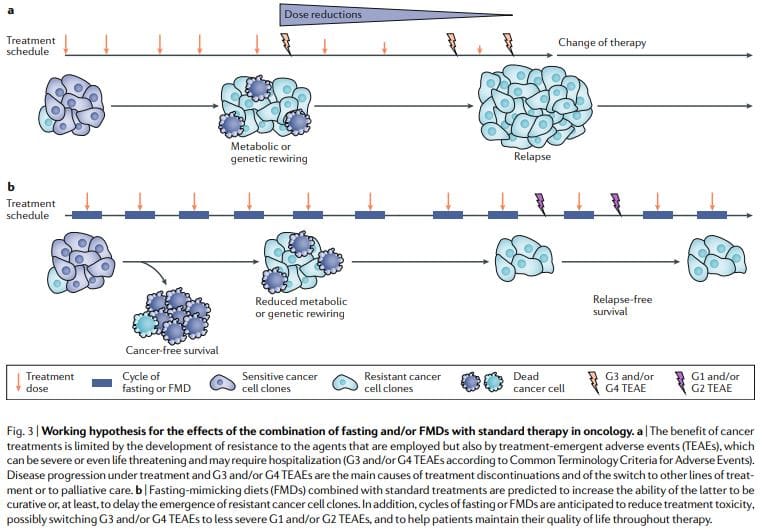
Висновки
Періодичне голодування або ящур постійно демонструють потужний протипухлинний ефект на моделях раку мишей, включаючи здатність потенціювати хіміопроменеву терапію та ІТК та викликати протираковий імунітет. Цикли ящуру є більш здійсненними, ніж режими хронічної дієти, оскільки вони дозволяють пацієнтам регулярно споживати їжу під час ящуру, підтримувати нормальну дієту між циклами і не призводять до сильної втрати ваги та, можливо, згубного впливу на імунну та ендокринну системи. Примітно, що як самостійна терапія, періодичне голодування або цикли ящуру, ймовірно, демонструють обмежену ефективність проти встановлених пухлин. Насправді, у мишей голодування або ящур впливають на прогресування ряду ракових захворювань так само, як і хіміотерапія, але окремо вони рідко відповідають ефекту, отриманому в комбінації з ліками від раку, що може призвести до виживання без раку11,59. Таким чином, ми припускаємо, що саме комбінація періодичних циклів ящуру зі стандартними методами лікування має найвищий потенціал для сприяння виживанню пацієнтів без раку, як припускають мишачі моделі11,59 (рис. 3).
Ця комбінація може бути особливо ефективною з кількох причин: по-перше, ліки від раку та інші методи лікування можуть бути ефективними, але частина пацієнтів не реагує, оскільки ракові клітини використовують альтернативні метаболічні стратегії, що ведуть до виживання. Ці альтернативні метаболічні режими набагато важче підтримувати в умовах голодування або ящуру через дефіцит або зміни глюкози, деяких амінокислот, гормонів і факторів росту, а також через інші невідомі шляхи, що призводять до загибелі клітин. По-друге, голодування або ящур можуть запобігти або зменшити набуття резистентності. По-третє, голодування або ящур захищають нормальні клітини та органи від побічних ефектів, викликаних широким спектром ліків від раку. На основі доклінічних і клінічних доказів доцільності, безпеки та ефективності (при зниженні IGF1, вісцерального жиру
Крім того, важливо застосовувати ящури з розумінням механізмів дії, оскільки вони діють
Поточні клінічні дослідження ящуру у пацієнтів з раком63,65 дадуть більш чіткі відповіді щодо того, чи допомагає призначення періодичних ящурів у поєднанні зі звичайними протипухлинними засобами покращити переносимість та активність останніх. Важливо враховувати, що ящур не буде ефективним у зменшенні побічних ефектів лікування раку у всіх пацієнтів, і вони також не будуть працювати над підвищенням ефективності всіх видів терапії, але вони мають великий потенціал зробити це принаймні на певну частину та, можливо, для більшої частини пацієнтів і ліків. Слабкі пацієнти або пацієнти з недостатнім харчуванням або пацієнти з ризиком недоїдання не повинні залучатися до клінічних досліджень натщесерце або ящуру, а стан харчування пацієнтів та анорексію слід ретельно контролювати під час клінічних досліджень.
Список використаної літератури:
Інформація в цьому документі на "Голодування та рак: молекулярні механізми та клінічне застосування" не призначений для заміни особистих стосунків із кваліфікованим медичним працівником або ліцензованим лікарем і не є медичною консультацією. Ми заохочуємо вас приймати рішення щодо охорони здоров’я на основі ваших досліджень і партнерства з кваліфікованим медичним працівником.
Інформація в блозі та обговорення обсягу
Наша інформаційна сфера обмежується хіропрактикою, опорно-руховим апаратом, фізичними препаратами, оздоровленням, що сприяє етіологічному вісцеросоматичні порушення у клінічних презентаціях, клінічній динаміці асоційованого соматовісцерального рефлексу, комплексах підвивиху, чутливих питаннях здоров’я та/або статей, темах та дискусіях з функціональної медицини.
Надаємо та презентуємо клінічне співробітництво з фахівцями різних галузей. Кожен фахівець керується своєю професійною сферою практики та юрисдикцією ліцензування. Ми використовуємо протоколи функціонального здоров’я та оздоровлення для лікування та підтримки догляду за травмами або розладами опорно-рухового апарату.
Наші відео, дописи, теми, предмети та висновки охоплюють клінічні питання, проблеми та теми, які стосуються та прямо чи опосередковано підтримують нашу клінічну практику.*
Наш офіс обґрунтовано намагався надати підтверджувальні цитати та визначив відповідне дослідження або дослідження, що підтверджують наші публікації. За запитом ми надаємо копії допоміжних наукових досліджень, доступні регуляторним комісіям та громадськості.
Ми розуміємо, що ми розглядаємо питання, які потребують додаткового пояснення того, як це може допомогти в певному плані догляду або протоколі лікування; тому для подальшого обговорення вищезазначеної теми, будь ласка, не соромтеся запитувати Доктор Алекс Хіменес, округ Колумбія, Або зв'яжіться з нами за адресою 915-850-0900.
Ми тут, щоб допомогти вам та вашій родині.
Благословення
Д-р Алекс Хіменес Постійного струму, MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
електронна пошта: coach@elpasofunctionalmedicine.com
Ліцензія доктора хіропрактики (DC) у Техас & Нью-Мексико*
Техас, округ Колумбія, номер ліцензії TX5807, Нью-Мексико, округ Колумбія Номер ліцензії NM-DC2182
Ліцензія дипломованої медсестри (RN*) in Флорида
Ліцензія Флориди Ліцензія RN # RN9617241 (Контрольний номер 3558029)
Компактний статус: Мультидержавна ліцензія: Уповноважений на практику в Стани 40*
Доктор Алекс Хіменес, округ Колумбія, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Моя цифрова візитна картка