Нейрогенні запалення, або NI, це фізіологічний процес, коли медіатори виводяться безпосередньо з шкірних нервів для початку запальної реакції. Це призводить до виникнення місцевих запальних реакцій, включаючи еритему, набряк, підвищення температури, чутливість і біль. Тонкі немієлінові аферентні соматичні С-волокна, які реагують на механічні та хімічні подразнення низької інтенсивності, значною мірою відповідають за вивільнення цих медіаторів запалення.
При стимуляції ці нервові шляхи в шкірних нервах швидко вивільняють енергійні нейропептиди або речовину P і пептид, пов’язаний з геном кальцитоніну (CGRP), швидко в мікросередовище, викликаючи серію запальних реакцій. Існує суттєва відмінність в імуногенному запаленні, це найперша захисна та репаративна реакція імунної системи, коли патоген потрапляє в організм, тоді як нейрогенне запалення передбачає прямий зв’язок між нервовою системою та запальними реакціями. Незважаючи на те, що нейрогенне запалення та імунологічне запалення можуть існувати одночасно, їх клінічно не можна відрізнити. Метою статті нижче є обговорення механізму нейрогенного запалення та ролі периферичної нервової системи в захисті хазяїна та імунопатології.
зміст
Нейрогенне запалення - роль периферичної нервової системи в захисті господаря та імунопатології
абстрактний
Традиційно вважають, що периферична нервова та імунна системи виконують окремі функції. Однак ця грань стає все більш розмитою через нові уявлення про нейрогенне запалення. Ноцицепторні нейрони мають багато тих же шляхів молекулярного розпізнавання небезпеки, що й імунні клітини, і у відповідь на небезпеку периферична нервова система безпосередньо спілкується з імунною системою, утворюючи інтегрований захисний механізм. Щільна іннерваційна мережа сенсорних і вегетативних волокон в периферичних тканинах і висока швидкість нейронної трансдукції дозволяють швидко локально і системно нейрогенну модуляцію імунітету. Периферичні нейрони також відіграють значну роль у імунній дисфункції при аутоімунних та алергічних захворюваннях. Тому розуміння скоординованої взаємодії периферичних нейронів з імунними клітинами може просунути терапевтичні підходи для підвищення захисту господаря та придушення імунопатології.
Вступ
Дві тисячі років тому Цельс визначив запалення як чотири основні ознаки: Dolor (біль), Calor (спека), Rubor (почервоніння) і Tumor (набряк), спостереження, яке вказує на те, що активація нервової системи була визнана невід'ємною запалення. Однак з тих пір біль в основному розглядався як симптом, а не учасник зародження запалення. З цієї точки зору ми показуємо, що периферична нервова система відіграє пряму та активну роль у модуляції вродженого та адаптивного імунітету, так що імунна та нервова системи можуть мати спільну інтегровану захисну функцію в захисті господаря та реакції на пошкодження тканин, складної взаємодія, що також може призвести до патології при алергічних та аутоімунних захворюваннях.
Виживання організмів критично залежить від здатності створити захист від потенційної шкоди від пошкодження тканин та інфекції. Захист хазяїна включає як поведінку уникнення для усунення контакту з небезпечним (шкідливим) середовищем (нейронна функція), так і активну нейтралізацію патогенів (імунна функція). Традиційно роль імунної системи в боротьбі з інфекційними агентами та усуненні пошкоджень тканин вважалася досить відмінною від ролі нервової системи, яка перетворює шкідливі навколишні та внутрішні сигнали в електричну активність для вироблення відчуттів і рефлексів (рис. 1). Ми вважаємо, що ці дві системи фактично є складовими єдиного захисного механізму. Соматосенсорна нервова система ідеально влаштована для виявлення небезпеки. По-перше, всі тканини, які сильно піддаються впливу зовнішнього середовища, наприклад епітеліальні поверхні шкіри, легенів, сечовивідних і травного тракту, щільно іннервуються ноцицепторами, високопороговими больовими чутливими волокнами. По-друге, передача шкідливих зовнішніх подразників відбувається майже миттєво, на порядки швидше, ніж мобілізація вродженої імунної системи, і, отже, може бути «першим реагентом» у захисті господаря.
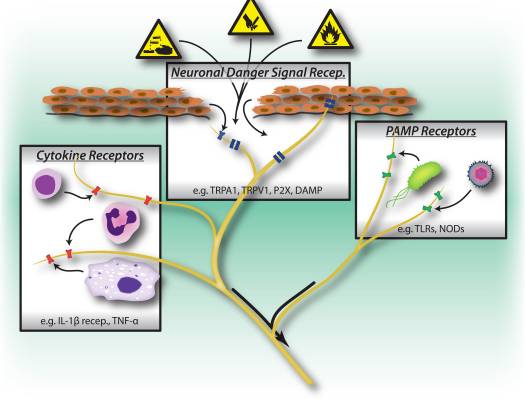
Малюнок 1: Шкідливі подразники, мікробні та запальні шляхи розпізнавання викликають активацію периферичної нервової системи. Сенсорні нейрони володіють декількома засобами виявлення присутності шкідливих/шкідливих подразників. 1) Рецептори сигналу небезпеки, включаючи канали TRP, канали P2X та рецептори молекулярного шаблону, пов’язаного з небезпекою (DAMP), розпізнають екзогенні сигнали з навколишнього середовища (наприклад, тепло, кислотність, хімічні речовини) або ендогенні сигнали небезпеки, що виділяються під час травми/пошкодження тканин (наприклад, АТФ, сечова кислота, гідроксиноненали). 2) Рецептори розпізнавання шаблонів (PRR), такі як Toll-подібні рецептори (TLR) і Nod-подібні рецептори (NLR), розпізнають молекулярні структури, пов’язані з патогенами (PAMP), що виділяються під час інвазії бактерій або вірусів. 3) Рецептори цитокінів розпізнають фактори, що секретуються імунними клітинами (наприклад, IL-1beta, TNF-alpha, NGF), які активують мап-кінази та інші сигнальні механізми для підвищення збудливості мембрани.
На додаток до ортодромних входів у спинний і головний мозок з периферії, потенціали дії в ноцицепторних нейронах також можуть передаватися антидромно через точки розгалуження назад до периферії, аксонний рефлекс. Вони разом із тривалою локальною деполяризацією призводять до швидкого та локального вивільнення нейронних медіаторів як з периферичних аксонів, так і з терміналів (рис. 2). викликає вазодилатацію шкіри, що призвело до концепції «нейрогенного запалення», незалежного від того, що виробляється імунною системою (рис. 1).
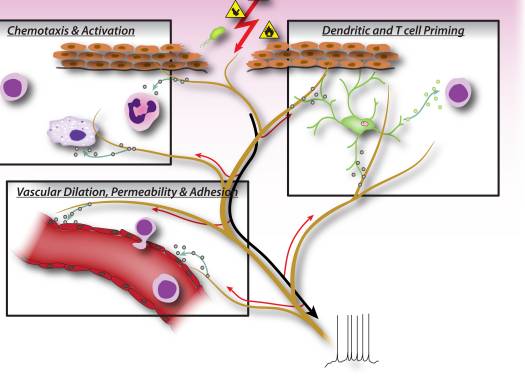
Малюнок 2: Нейронні фактори, що вивільняються з сенсорних нейронів ноцицепторів, безпосередньо впливають на хемотаксис лейкоцитів, судинну гемодинаміку та імунну відповідь. Коли шкідливі подразники активують аферентні сигнали в чутливих нервах, генеруються антидромні аксонні рефлекси, які індукують вивільнення нейропептидів на периферичних терміналах нейронів. Ці молекулярні медіатори мають кілька запальних дій: 1) Хемотаксис і активація нейтрофілів, макрофагів і лімфоцитів до місця пошкодження та дегрануляція тучних клітин. 2) Сигнал до ендотеліальних клітин судин для збільшення кровотоку, судинного протікання та набряку. Це також полегшує залучення запальних лейкоцитів. 3) Праймування дендритних клітин для стимулювання подальшої диференціації Т-хелперних клітин у підтипи Th2 або Th17.

Малюнок 3: Хронологія прогресу в розумінні нейрогенних аспектів запалення від Цельса до наших днів.
Нейрогенечне запалення опосередковується вивільненням нейропептидів пептиду, пов’язаного з геном кальцитоніну (CGRP) і субстанції P (SP) із ноцицепторів, які діють безпосередньо на ендотеліальні та гладком’язові клітини судин 2–5. CGRP викликає вазодилатаційні ефекти 2, 3, тоді як SP збільшує проникність капілярів, що призводить до екстравазації плазми та набряку 4, 5, сприяючи рубору, калору та пухлині Цельса. Однак ноцицептори вивільняють багато додаткових нейропептидів (онлайн-база даних: www.neuropeptides.nl/), включаючи адреномедулін, нейрокініни A і B, вазоактивний кишковий пептид (VIP), нейропептид (NPY) і гастрин-рилізинг пептид (GRP), а також інші молекулярні медіатори, такі як глутамат, оксид азоту (NO) і цитокіни, такі як еотаксин 6.
Тепер ми розуміємо, що медіатори, що вивільняються з сенсорних нейронів на периферії, не тільки діють на судинну мережу, а й безпосередньо притягують і активують вроджені імунні клітини (огічні клітини, дендритні клітини) і адаптивні імунні клітини (Т-лімфоцити) 7�12. При гострому ураженні тканин ми припускаємо, що нейрогенне запалення є захисним, полегшуючи фізіологічне загоєння ран та імунний захист від патогенів шляхом активації та залучення імунних клітин. Однак такі нейроімунні комунікації також, ймовірно, відіграють важливу роль у патофізіології алергічних та аутоімунних захворювань, посилюючи патологічні або дезадаптивні імунні реакції. На тваринних моделях ревматоїдного артриту, наприклад, Левін та його колеги показали, що денервація суглоба призводить до вражаючого ослаблення запалення, що залежить від нейронної експресії речовини P 13, 14. У недавніх дослідженнях алергічного запалення дихальних шляхів, коліту та псоріаз, первинні сенсорні нейрони відіграють центральну роль в ініціації та посиленні активації вродженого та адаптивного імунітету 15�17.
Тому ми припускаємо, що периферична нервова система грає не тільки пасивну роль у захисті господаря (виявлення шкідливих подразників та ініціювання поведінки уникнення), а й активну роль у взаємодії з імунною системою в модуляції відповідей на шкідливі дії та боротьбі з ними. стимули, роль, яку можна змінити, щоб сприяти захворюванню.
Спільні шляхи розпізнавання небезпеки в периферичній нервовій та вродженій імунній системах
Периферичні сенсорні нейрони пристосовані до розпізнавання небезпеки для організму завдяки своїй чутливості до інтенсивних механічних, теплових і подразливих хімічних подразників (рис. 1). Іонні канали транзиторного рецепторного потенціалу (TRP) є найбільш вивченими молекулярними медіаторами ноцицепції, які здійснюють неселективне надходження катіонів при активації різними шкідливими подразниками. TRPV1 активується високими температурами, низьким pH і капсаїцином, компонентом валіноїдного подразника перцю чилі 18. TRPA1 опосередковує виявлення реактивних хімічних речовин, включаючи подразники навколишнього середовища, такі як сльозогінний газ та промислові ізотіоціанати 19, але, що більш важливо, він також активується під час тканин. пошкодження ендогенними молекулярними сигналами, включаючи 4-гідроксиноненал і простагландини 20, 21.
Цікаво, що сенсорні нейрони мають багато тих самих шляхів рецепторів молекулярного розпізнавання патогенів і небезпеки, що й клітини вродженого імунітету, що дозволяє їм також виявляти патогени (рис. 1). В імунній системі мікробні патогени виявляються за допомогою рецепторів розпізнавання шаблонів, закодованих зародковою лінією (PRR), які розпізнають широко консервативні молекулярні структури, пов’язані з екзогенними патогенами (PAMP). Перші PRR, які були ідентифіковані, були членами сімейства toll-like рецепторів (TLR), які зв’язуються з дріжджами, компонентами клітинної стінки бактерій та вірусною РНК 22. Після активації PRR вмикаються сигнальні шляхи, що знаходяться нижче по ходу, що індукують продукцію та активацію цитокінів. адаптивного імунітету. На додаток до TLR, клітини вродженого імунітету активуються під час пошкодження тканин ендогенними сигналами небезпеки, також відомими як молекулярні паттерни, пов’язані з пошкодженням (DAMP) або алармінами 23, 24. Ці сигнали небезпеки включають HMGB1, сечову кислоту та вивільнені білки теплового шоку. відмираючи клітини під час некрозу, активуючи імунні клітини під час неінфекційних запальних реакцій.
PRR, включаючи TLR 3, 4, 7 і 9, експресуються ноцицепторними нейронами, а стимуляція лігандами TLR призводить до індукції внутрішніх струмів і сенсибілізації ноцицепторів до інших больових подразників 25. Крім того, активація сенсорних нейронів іміквімодом лігандом TLR27 призводить до активації специфічного для свербіння сенсорного шляху 7. Ці результати вказують на те, що біль і свербіж, пов’язані з інфекцією, частково можуть бути викликані безпосередньою активацією нейронів факторами, що походять від патогена, які, у свою чергу, активувати імунні клітини через периферичне вивільнення нейронних сигнальних молекул.
Основним DAMP/аларміном, що виділяється під час пошкодження клітин, є АТФ, який розпізнається пуринергічними рецепторами як на ноцицепторних нейронах, так і на імунних клітинах 28. Пуринергічні рецептори складаються з двох сімейств: P30X-рецептори, ліганд-керовані катіонні канали та P2Y-рецептори, рецептори, пов’язані з G-білком. У ноцицепторних нейронах розпізнавання АТФ відбувається через P2X2, що призводить до швидкої десенсибілізації катіонних струмів і болю 3, 28 (рис. 30), тоді як рецептори P1Y сприяють активації ноцицептора шляхом сенсибілізації TRP і вольтажзалежних натрієвих каналів. У макрофагах зв’язування АТФ з рецепторами P2X2 призводить до гіперполяризації та активації інфламасоми, молекулярного комплексу, важливого для генерації IL-7beta та IL-1 18. Отже, АТФ є потужним сигналом небезпеки, який активує як периферичні нейрони, так і вроджені нейрони. імунітет під час травми, а деякі дані навіть свідчать про те, що нейрони експресують частини молекулярного механізму інфламасоми 29.
Зворотною стороною сигналів небезпеки в ноцицепторах є роль каналів TRP в активації імунних клітин. TRPV2, гомолог TRPV1, активований шкідливим теплом, експресується на високих рівнях у клітинах вродженого імунітету 32. Генетична абляція TRPV2 призвела до дефектів фагоцитозу макрофагів і очищення бактеріальних інфекцій 32. Тучні клітини також експресують канали TRPV, які можуть безпосередньо опосередковувати їх дегрануляція 33. Залишається визначити, чи ендогенні сигнали небезпеки активують імунні клітини так само, як і ноцицептори.
Ключовим засобом зв’язку між імунними клітинами та нейронами-ноцицепторами є цитокіни. Після активації цитокінових рецепторів шляхи передачі сигналу активуються в сенсорних нейронах, що веде до фосфорилювання мембранних білків, включаючи TRP і вольт-залежні канали (рис. 1). Результуюча сенсибілізація ноцицепторів означає, що зазвичай нешкідливі механічні та теплові подразники тепер можуть активувати ноцицептори. Інтерлейкін 1 бета і TNF-альфа є двома важливими цитокінами, які вивільняються клітинами вродженого імунітету під час запалення. IL-1beta і TNF-alpha безпосередньо сприймаються ноцицепторами, які експресують споріднені рецептори, індукують активацію кіназ карти р38, що призводить до підвищення збудливості мембрани 34÷36. Фактор росту нервів (NGF) і простагландин E(2) також є основними медіаторами запалення, що вивільняються з імунних клітин, які діють безпосередньо на периферичні сенсорні нейрони, викликаючи сенсибілізацію. Важливим ефектом сенсибілізації ноцицепторів імунними факторами є посилене вивільнення нейропептидів на периферичних терміналах, які додатково активують імунні клітини, тим самим викликаючи петлю позитивного зворотного зв’язку, яка стимулює і полегшує запалення.
Сенсорна нервова система Контроль вродженого та адаптивного імунітету
На ранніх фазах запалення сенсорні нейрони сигналізують резидентним тучним клітинам і дендритним клітинам, які є вродженими імунними клітинами, важливими для ініціювання імунної відповіді (рис. 2). Анатомічні дослідження показали пряме приєднання терміналів з тучними клітинами, а також з дендритними клітинами, а нейропептиди, що вивільняються з ноцицепторів, можуть викликати дегрануляцію або вироблення цитокінів у цих клітинах 7, 9, 37. Ця взаємодія відіграє важливу роль у алергічних дихальних шляхах. запалення та дерматити 10�12.
Під час ефекторної фази запалення імунні клітини повинні знайти шлях до конкретного місця ураження. Багато медіаторів, що вивільняються з сенсорних нейронів, нейропептидів, хемокінів і глутамату, є хемотаксичними для нейтрофілів, еозинофілів, макрофагів і Т-клітин і підсилюють ендотеліальну адгезію, що сприяє хомінгу імунних клітин 6, 38÷41 (рис. 2). Крім того, деякі дані свідчать про те, що нейрони можуть безпосередньо брати участь у ефекторній фазі, оскільки самі нейропептиди можуть мати прямі антимікробні функції 42.
Сигнальні молекули, отримані від нейронів, також можуть керувати типом запалення, сприяючи диференціації або специфікації різних типів адаптивних імунних Т-клітин. Антиген фагоцитується і обробляється клітинами вродженого імунітету, які потім мігрують до найближчого лімфатичного вузла і представляють антигенний пептид навним Т-клітинам. Залежно від типу антигену, костимулюючих молекул на клітині вродженого імунітету та комбінації специфічних цитокінів, нативні Т-клітини дозрівають до специфічних підтипів, які найкраще служать запальним зусиллям, спрямованим на усунення патогенного подразника. CD4 Т-клітини або Т-хелперні (Th) клітини можна розділити на чотири основні групи: Th1, Th2, Th17 і T-регуляторні клітини (Treg). Th1 клітини в основному беруть участь у регуляції імунних відповідей на внутрішньоклітинні мікроорганізми та органоспецифічні аутоімунні захворювання; Th2 є критичними для імунітету проти позаклітинних патогенів, таких як гельмінти, і є відповідальними за алергічні запальні захворювання; Клітини Th17 відіграють центральну роль у захисті від мікробних проблем, таких як позаклітинні бактерії та гриби; Клітини Treg беруть участь у підтримці самотолерантності та регуляції імунних реакцій. Цей процес дозрівання Т-клітин, мабуть, перебуває під значним впливом медіаторів сенсорних нейронів. Нейропептиди, такі як CGRP і VIP, можуть зміщувати дендритні клітини до імунітету типу Th2 і знижувати імунітет типу Th1, сприяючи виробленню певних цитокінів і пригнічуючи інші, а також зменшуючи або посилюючи міграцію дендритних клітин до місцевих лімфатичних вузлів 8 , 10, 43. Сенсорні нейрони також вносять значний внесок у алергічне (переважно зумовлене Th2) запалення 17. На додаток до регуляції клітин Th1 і Th2, інші нейропептиди, такі як SP і Hemokinin-1, можуть стимулювати запальну відповідь більше до Th17 або Treg 44, 45, що означає, що нейрони також можуть брати участь у регуляції усунення запалення. При імунопатологіях, таких як коліт і псоріаз, блокада нейронних медіаторів, таких як речовина P, може значно послабити Т-клітину та імуноопосередковане пошкодження 15, хоча антагонізм одного медіатора сам по собі може мати лише обмежений вплив на нейрогенне запалення.
Беручи до уваги, що сигнальні молекули, що вивільняються з периферичних чутливих нервових волокон, регулюють не тільки дрібні кровоносні судини, а й хемотаксис, хомінг, дозрівання та активацію імунних клітин, стає зрозумілим, що нейро-імунна взаємодія набагато складніша, ніж вважалося раніше (рис. . 2). Крім того, цілком можливо, що на різні стадії та типи імунних реакцій впливають не окремі нейронні медіатори, а скоріше специфічні комбінації сигнальних молекул, що вивільняються з ноцицепторів.
Вегетативний рефлекторний контроль імунітету
Роль «рефлекторного» кола холінергічної вегетативної нервової системи в регуляції периферичних імунних реакцій також виявляється помітною 46. Блукаючий – це головний парасимпатичний нерв, що з’єднує стовбур мозку з вісцеральними органами. Роботи Кевіна Трейсі та інших вказують на потужні генералізовані протизапальні реакції при септичному шоці та ендотоксемії, викликані активністю еферентного блукаючого нерва, що призводить до пригнічення периферичних макрофагів 47. Блукаюча речовина активує нейрони периферичного адренергічного ганглія целіакії, що іннервують селезінку, що призводить до вивільнення ацетилхоліну, який зв’язується з альфа-49 нікотиновими рецепторами на макрофагах в селезінці та шлунково-кишковому тракті. Це викликає активацію сигнального шляху JAK7/STAT2 SOCS3, який потужно пригнічує транскрипцію TNF-альфа 3. Адренергічний целіакічний ганглій також безпосередньо спілкується з підгрупою Т-клітин пам’яті, що виробляють ацетилхолін, які пригнічують запальні макрофаги 47.
Інваріантні природні Т-клітини-вбивці (iNKT) – це спеціалізована підгрупа Т-клітин, які розпізнають мікробні ліпіди в контексті CD1d замість пептидних антигенів. Клітини NKT є ключовою популяцією лімфоцитів, що беруть участь у боротьбі з інфекційними патогенами та регуляції системного імунітету. Клітини NKT знаходяться і переміщуються в основному через судинну мережу та синусоїди селезінки та печінки. Симпатичні бета-адренергічні нерви в печінці безпосередньо сигналізують про модуляцію активності NKT-клітин 50. Наприклад, під час мишачої моделі інсульту (MCAO), рухливість NKT-клітин печінки була помітно пригнічена, що було скасовано симпатичною денервацією або бета-адренергічними антагоністами. Крім того, ця імуносупресивна активність норадренергічних нейронів на клітинах NKT призвела до збільшення системної інфекції та ураження легень. Таким чином, еферентні сигнали від вегетативних нейронів можуть опосередковувати потужну імуносупресію.

Інсайт доктора Алекса Хіменеса
Нейрогенне запалення - це місцева запальна реакція, що генерується нервовою системою. Вважається, що він відіграє фундаментальну роль у патогенезі різноманітних проблем зі здоров’ям, включаючи мігрень, псоріаз, астму, фіброміалгію, екзему, розацеа, дистонію та множинну хімічну чутливість. Хоча нейрогенне запалення, пов’язане з периферичною нервовою системою, було детально досліджено, концепція нейрогенного запалення в центральній нервовій системі все ще потребує подальших досліджень. Однак, згідно з кількома дослідженнями, дефіцит магнію вважається основною причиною нейрогенного запалення. Наступна стаття демонструє огляд механізмів нейрогенного запалення в нервовій системі, що може допомогти медичним працівникам визначити найкращий підхід до лікування різноманітних проблем зі здоров’ям, пов’язаних із нервовою системою.
Висновки
Які специфічні ролі соматосенсорної та вегетативної нервової систем у регуляції запалення та імунної системи (рис. 4)? Активація ноцицепторів призводить до локальних аксонних рефлексів, які локально залучають і активують імунні клітини, і тому є переважно прозапальними та просторово обмеженими. Навпаки, вегетативна стимуляція призводить до системної імуносупресії, впливаючи на пули імунних клітин у печінці та селезінці. Механізми аферентної передачі сигналів на периферії, що ведуть до запуску імуносупресивного вагусного холінергічного рефлексу, недостатньо вивчені. Однак 80–90% вагусних волокон є первинними аферентними сенсорними волокнами, і тому сигнали від нутрощів, багато з яких потенційно керуються імунними клітинами, можуть призвести до активації інтернейронів у стовбурі мозку і через них до виходу в еферентні волокна блукаючого нерва 46.
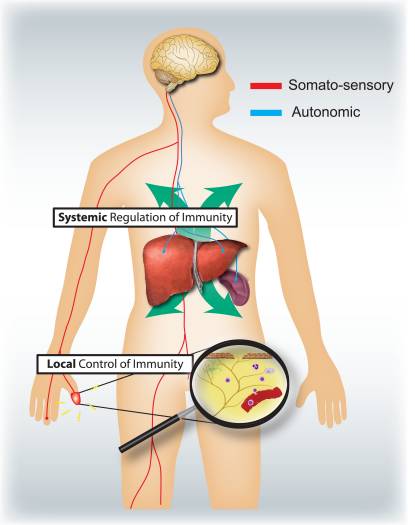
Малюнок 4: Сенсорна та вегетативна нервова системи модулюють відповідно місцеві та системні імунні реакції. Ноцицептори, що іннервують епітеліальні поверхні (наприклад, шкіру та легені), викликають локалізовані запальні реакції, активуючи тучні клітини та дендритні клітини. При алергічному запаленні дихальних шляхів, дерматиті та ревматоїдному артриті ноцицепторні нейрони відіграють роль у стимулюванні запалення. Навпаки, вегетативні ланцюги, що іннервують вісцеральні органи (наприклад, селезінку та печінку), регулюють системні імунні реакції, блокуючи активацію макрофагів і NKT-клітин. При інсульті та септичній ендотоксемії ці нейрони відіграють імуносупресивну роль.
Як правило, час і характер запалення, будь то під час інфекції, алергічних реакцій або аутоімунних патологій, визначаються категоріями залучених імунних клітин. Важливо знати, які різні типи імунних клітин регулюються сенсорними та вегетативними сигналами. Систематична оцінка того, які медіатори можуть вивільнятися з ноцицепторів і вегетативних нейронів, а також експресія рецепторів для них різними вродженими та адаптивними імунними клітинами може допомогти вирішити це питання.
В ході еволюції розвивалися подібні молекулярні шляхи виявлення небезпеки як для вродженого імунітету, так і для ноцицепції, хоча клітини мають абсолютно різні лінії розвитку. У той час як PRR і шкідливі ліганд-керовані іонні канали окремо вивчаються імунологами та нейробіологами, межа між цими двома полями все більше розмивається. Під час пошкодження тканин і патогенної інфекції вихід сигналів небезпеки, ймовірно, призведе до скоординованої активації як периферичних нейронів, так і імунних клітин із складним двонаправленим зв’язком та інтегрованим захистом господаря. Анатомічне розташування ноцицепторів на межі з навколишнім середовищем, швидкість нейронної трансдукції та їхня здатність вивільняти потужні коктейлі медіаторів імунної дії дозволяють периферичної нервової системи активно модулювати вроджену імунну відповідь і координувати наступний адаптивний імунітет. І навпаки, ноцицептори дуже чутливі до імунних медіаторів, які активують і сенсибілізують нейрони. Таким чином, нейрогенне та імуноопосередковане запалення не є незалежними утвореннями, а діють разом як засоби раннього попередження. Однак периферична нервова система також відіграє важливу роль у патофізіології та, можливо, етіології багатьох імунних захворювань, таких як астма, псоріаз або коліт, оскільки її здатність активувати імунну систему може посилювати патологічне запалення 15. Таким чином, лікування імунних розладів може включати націлення на ноцицептори, а також на імунні клітини.
Подяки
Ми дякуємо NIH за підтримку (2R37NS039518).
НасамкінецьРозуміння ролі нейрогенного запалення, коли мова йде про захист господаря та імунопатологію, є важливим для визначення належного підходу до лікування різноманітних проблем зі здоров’ям нервової системи. Дивлячись на взаємодію периферичних нейронів з імунними клітинами, медичні працівники можуть просувати терапевтичні підходи, щоб ще більше допомогти підвищити захист господаря, а також придушити імунопатологію. Мета наведеної вище статті – допомогти пацієнтам зрозуміти клінічну нейрофізіологію нейропатії, серед інших проблем зі здоров’ям ушкоджень нервів. Інформація з посиланням на Національний центр біотехнологічної інформації (NCBI). Обсяг нашої інформації обмежений хіропрактикою, а також травмами та станами хребта. Щоб обговорити тему, зверніться до доктора Хіменеса або зв’яжіться з нами за адресою�915-850-0900.
Куратор доктор Алекс Хіменес
Додаткові теми: Біль у спині
Біль у спині є однією з найпоширеніших причин інвалідності та пропущених робочих днів у всьому світі. Насправді, біль у спині вважається другою за поширеністю причиною відвідувань лікаря, переважаючи лише інфекції верхніх дихальних шляхів. Приблизно 80 відсотків населення відчувають біль у спині принаймні один раз протягом життя. Хребет – це складна структура, що складається з кісток, суглобів, зв’язок і м’язів, а також інших м’яких тканин. Через це травми та/або загострення стану, наприклад грижі диски, може зрештою призвести до симптомів болю в спині. Спортивні травми або травми в автомобільній катастрофі часто є найчастішою причиною болю в спині, однак іноді найпростіші рухи можуть мати хворобливі наслідки. На щастя, альтернативні варіанти лікування, такі як хіропрактика, можуть допомогти полегшити біль у спині за допомогою корекції хребта та ручних маніпуляцій, що в кінцевому підсумку покращує полегшення болю.

ДОДАТКО ВАЖЛИВА ТЕМА: Лікування болю в попереку
ІНШЕ ТЕМ: ДОДАТКОВО: Хронічний біль і лікування
Бланк
посилання
Закрити акордеон
Інформація в цьому документі на "Роль нейрогенного запалення" не призначений для заміни особистих стосунків із кваліфікованим медичним працівником або ліцензованим лікарем і не є медичною консультацією. Ми заохочуємо вас приймати рішення щодо охорони здоров’я на основі ваших досліджень і партнерства з кваліфікованим медичним працівником.
Інформація в блозі та обговорення обсягу
Наша інформаційна сфера обмежується хіропрактикою, опорно-руховим апаратом, фізичними препаратами, оздоровленням, що сприяє етіологічному вісцеросоматичні порушення у клінічних презентаціях, клінічній динаміці асоційованого соматовісцерального рефлексу, комплексах підвивиху, чутливих питаннях здоров’я та/або статей, темах та дискусіях з функціональної медицини.
Надаємо та презентуємо клінічне співробітництво з фахівцями різних галузей. Кожен фахівець керується своєю професійною сферою практики та юрисдикцією ліцензування. Ми використовуємо протоколи функціонального здоров’я та оздоровлення для лікування та підтримки догляду за травмами або розладами опорно-рухового апарату.
Наші відео, дописи, теми, предмети та висновки охоплюють клінічні питання, проблеми та теми, які стосуються та прямо чи опосередковано підтримують нашу клінічну практику.*
Наш офіс обґрунтовано намагався надати підтверджувальні цитати та визначив відповідне дослідження або дослідження, що підтверджують наші публікації. За запитом ми надаємо копії допоміжних наукових досліджень, доступні регуляторним комісіям та громадськості.
Ми розуміємо, що ми розглядаємо питання, які потребують додаткового пояснення того, як це може допомогти в певному плані догляду або протоколі лікування; тому для подальшого обговорення вищезазначеної теми, будь ласка, не соромтеся запитувати Доктор Алекс Хіменес, округ Колумбія, Або зв'яжіться з нами за адресою 915-850-0900.
Ми тут, щоб допомогти вам та вашій родині.
Благословення
Д-р Алекс Хіменес Постійного струму, MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
електронна пошта: coach@elpasofunctionalmedicine.com
Ліцензія доктора хіропрактики (DC) у Техас & Нью-Мексико*
Техас, округ Колумбія, номер ліцензії TX5807, Нью-Мексико, округ Колумбія Номер ліцензії NM-DC2182
Ліцензія дипломованої медсестри (RN*) in Флорида
Ліцензія Флориди Ліцензія RN # RN9617241 (Контрольний номер 3558029)
Компактний статус: Мультидержавна ліцензія: Уповноважений на практику в Стани 40*
Доктор Алекс Хіменес, округ Колумбія, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Моя цифрова візитна картка